31/2010. (V. 13.) EüM rendelet
31/2010. (V. 13.) EüM rendelet
a finanszírozási eljárásrendekről
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján,
a 7–12. § és a 20–21. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában kapott felhatalmazás alapján – a pénzügyminiszter feladat- és hatásköréről szóló 169/2006. (VII. 28.) Korm. rendelet 1. § a) pontjában meghatározott feladatkörében eljáró pénzügyminiszterrel egyetértésben –,
az egészségügyi miniszter feladat- és hatásköréről szóló 161/2006. (VII. 28.) Korm. rendelet 1. § b) pontjában meghatározott feladatkörömben eljárva a következőket rendelem el:
1. § E rendelet alkalmazása során az egyes főbb betegségcsoportok finanszírozási eljárásrendjének szerkesztése és szakmai egyeztetése lefolytatásának egységes szabályairól szóló 13/2009. (IV. 22.) EüM rendeletben foglalt fogalommeghatározásokat kell figyelembe venni.
2. § (1) A krónikus myeloid leukémia kezelésének finanszírozási eljárásrendjét az 1. melléklet tartalmazza.
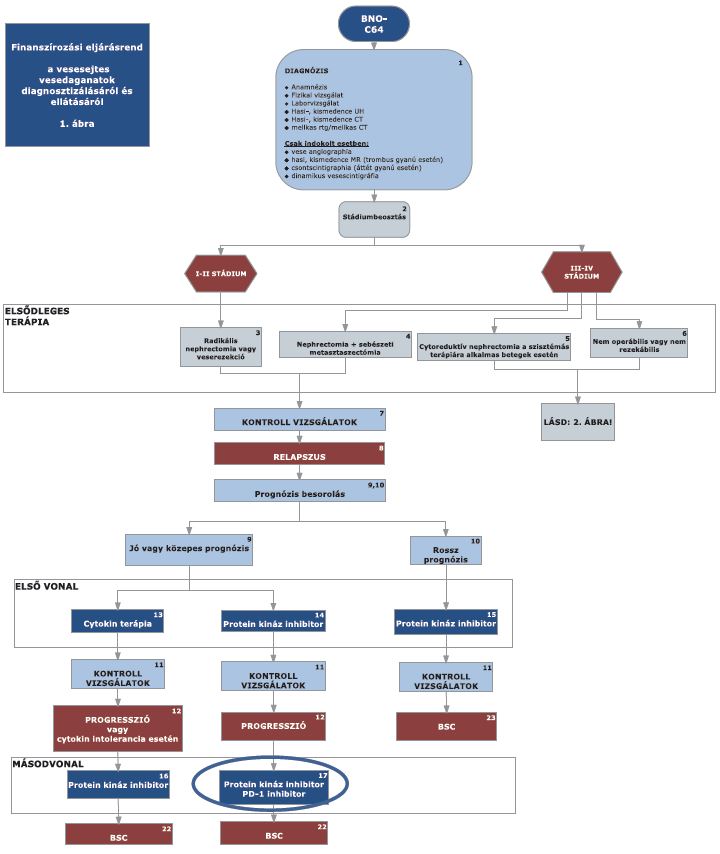
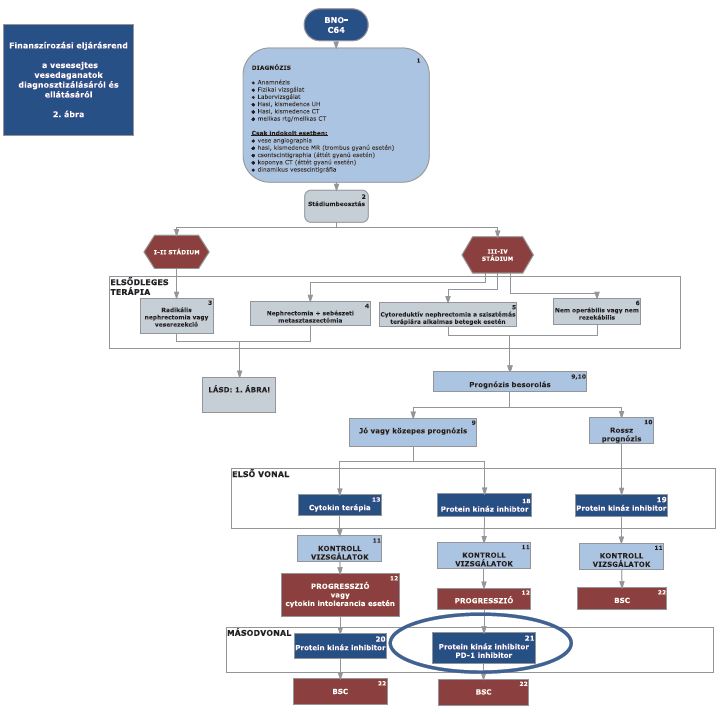
(2) A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 2. melléklet tartalmazza.
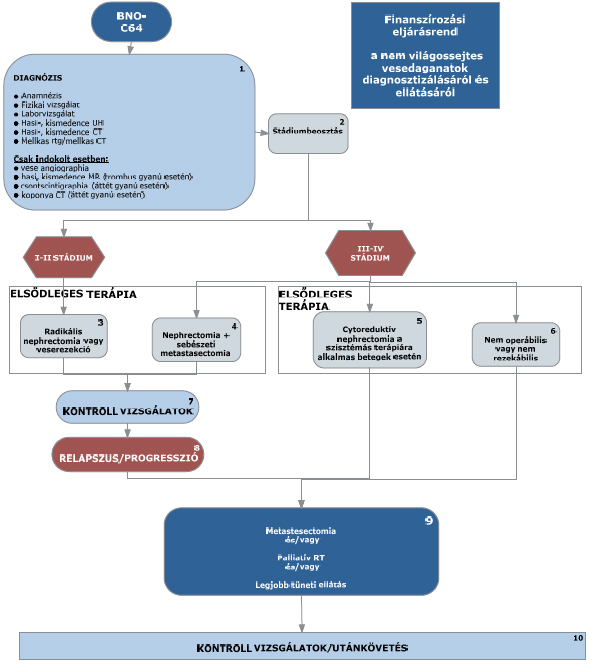
(3) A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 3. melléklet tartalmazza.
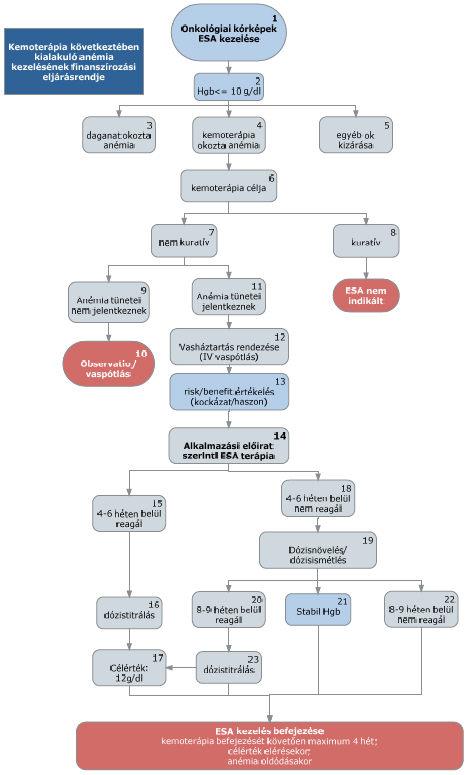
(4) A kemoterápia következtében kialakuló anémia kezelésének finanszírozási eljárásrendjét a 4. melléklet tartalmazza.
(5) A Parkinson betegségcsoport diagnosztikájának és kezelésének finanszírozási eljárásrendjét az 5. melléklet tartalmazza.
(6) A hepatitis B diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 6. melléklet tartalmazza.
3. § (1) A felnőttkori luminális Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 7. melléklet tartalmazza.
(2) A felnőttkori fisztulázó Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 8. melléklet tartalmazza.
(3) A colitis ulcerosa diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 9. melléklet tartalmazza.
(4) A plakkos psoriasis diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 10. melléklet tartalmazza.
(5) A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 11. melléklet tartalmazza.
(6) A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 12. melléklet tartalmazza.
4. § (1) A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 13. melléklet tartalmazza.
(2) Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 14. melléklet tartalmazza.
(3)1 Az oszteoporózis következtében kialakuló csonttörés primer prevenciójának finanszírozási eljárásrendjét a 15. melléklet tartalmazza.
(4)2 Az oszteoporózis következtében kialakuló csonttörés szekunder prevenciójának finanszírozási eljárásrendjét a 16. melléklet tartalmazza.
(5) A hepatitis C vírus okozta krónikus májgyulladás diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 17. melléklet tartalmazza.
(6) A gyermekkori Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 18. melléklet tartalmazza.
5. §3 (1) A myeloma multiplex kezelésének finanszírozási eljárásrendjét a 19. melléklet tartalmazza.
(2) A stroke elsődleges megelőzésének finanszírozási eljárásrendjét a 20. melléklet tartalmazza.
(3) Az újabb stroke megelőzésének finanszírozási eljárásrendjét a 21. melléklet tartalmazza.
(4) Az ischaemias stroke-ot elszenvedett, thrombolysisre alkalmas betegek ellátásának finanszírozási eljárásrendjét a 22. melléklet tartalmazza.
(5) A gyomordaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 23. melléklet tartalmazza.
(6) Az ST elevációval nem járó myocardialis infarktus és az instabil angina diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 24. melléklet tartalmazza.
(7) A stabil angina pectoris diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 25. melléklet tartalmazza.
(8) A nem-seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendjét a 26. melléklet tartalmazza.
(9) A seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendjét a 27. melléklet tartalmazza.
(10) A húgyhólyagrák diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 28. melléklet tartalmazza.
(11) A prosztata daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 29. melléklet tartalmazza.
(12) A szkizofrénia antipszichotikus gyógyszeres kezelésének finanszírozási eljárásrendjét a 30. melléklet tartalmazza.
(13) A sclerosis multiplex diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 31. melléklet tartalmazza.
(14) A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 32. melléklet tartalmazza.
(15) A rectum daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 33. melléklet tartalmazza.
(16)4
(17) A gyermekkori asthma bronchiale diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendjét a 35. melléklet tartalmazza.
(18) A krónikus obstruktív tüdőbetegség (COPD) diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendjét a 36. melléklet tartalmazza.
(19) Az asthma bronchiale diagnosztikája és gyógyszeres kezelése felnőttkorban finanszírozási eljárásrendjét a 37. melléklet tartalmazza.
(20) Korai és helyileg kiterjedt (nem távoli áttétes) nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 38. melléklet tartalmazza.
(21) Az ST-elevációval járó akut myocardiális infarktus diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 39. melléklet tartalmazza.
(22) Lokálisan kiterjedt inoperábilis és áttétes nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 40. melléklet tartalmazza.
(23) A kissejtes tüdődaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 41. melléklet tartalmazza.
6. § (1) Ez a rendelet – a (2) bekezdésben foglalt kivétellel – 2010. július 1-jén lép hatályba.
(2)5
7. §6
8. §7
9. §8
10. §9
11. §10
12. §11
13. §12
1. melléklet a 31/2010. (V. 13.) EüM rendelethez13
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések (C00-C97)
Krónikus myeloid leukémia (C9210)
2. Kórkép leírása
2.1. A krónikus myeloid leukémia (CML) idült, malignus myeloproliferatív betegség, klonális megbetegedés. Genetikai oka a 9. és 22. kromoszóma hosszú karjai közti reciprok transzlokáció (Philadelphia kromoszóma) következtében a 22. kromoszómán létrejövő BCR/ABL fúziós gén. A Philadelphia kromoszóma BCR/ABL fúziós génje egy kóros, konstitutív protein kináz aktivitással rendelkező BCR/ABL fúziós fehérjét kódol, mely megváltoztatja a sejtproliferációt és túlélést kontrolláló, sejten belüli jelátviteli utakat, úgy hogy ez a leukémiás sejteknek túlélési előnyt jelent a mutációt nem hordozó, ép sejtekhez képest.
2.2. A krónikus myeloid leukémiának három, jól elkülöníthető fázisát különböztethetjük meg:
2.2.1. A krónikus fázisban a blastsejtek aránya a vérben és a csontvelőben kisebb, mint 15%. Ezzel egyidejűleg a basophil sejtek aránya a perifériás vérképben kisebb, mint 20%, és a thrombocytaszám nagyobb 100 x 109/l-nél.
2.2.2. Az akcelerált fázis definiálására több kritériumrendszer ismert. A WHO meghatározása szerint a következő kritériumok egyike elegendő az akcelerált fázis kimondásához:
− a perifériás vérben vagy a csontvelő magvas sejtei között 10-19% a blastsejt,
− a perifériás vérben legalább 20% bazofil sejt van jelen,
− a trombocitaszám vagy 100 G/l alatt vagy 1000 G/l felett van az alkalmazott kezeléstől függetlenül,
− a fehérvérsejtszám és lépméret növekedése nem reagál a kezelésre,
− klonális evolúcióra utaló citogenetikai eltérés van jelen.
Emellett egyes definíciók a kritériumok között említik
− a csontvelői fibrózist,
− az ismeretlen eredetű láz jelenlétét, vagy
− az 5 napnál kisebb fehérvérsejt duplázódási időt.
2.2.3. A blastos krízis során a blastsejtek aránya a vérben vagy a csontvelőben legalább 20%, a csontvelőben nagy blasztos gócok látszanak vagy a splenomegalián kívül más extramedulláris betegség is fennáll.
2.3. A WHO 2002-es klasszifikációja szerint CML-nek csak az a betegség nevezhető, ahol a Philadelphia kromoszóma vagy a BCR/ABL fúziós gén kimutatható.
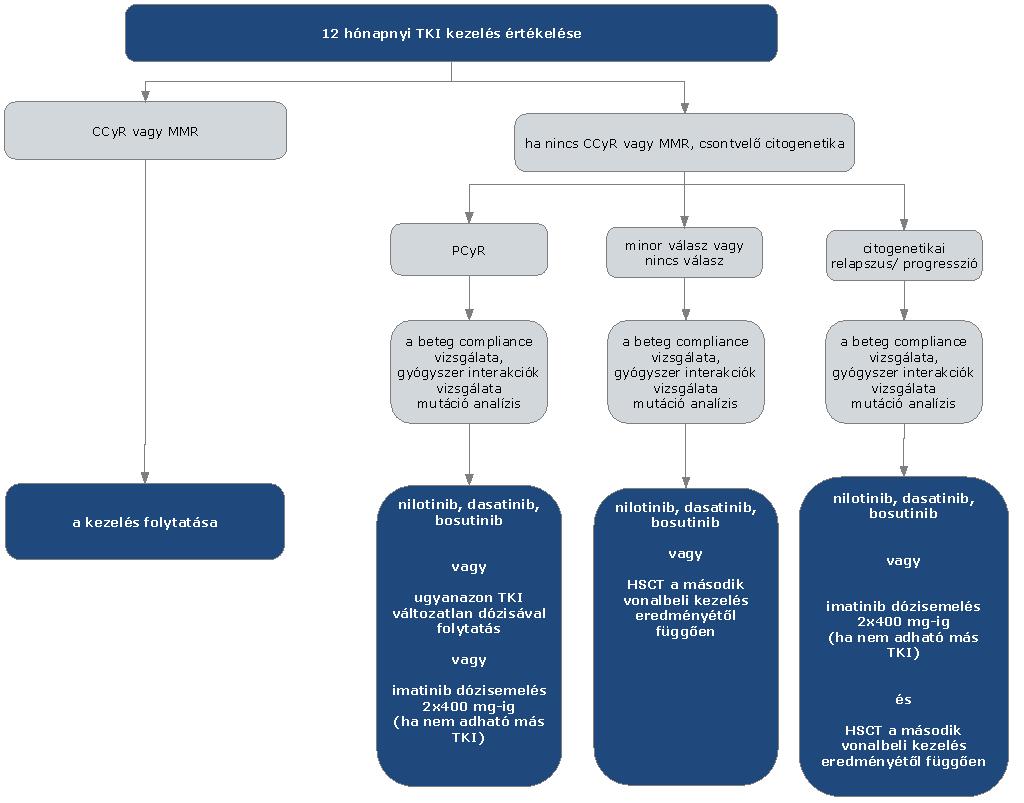
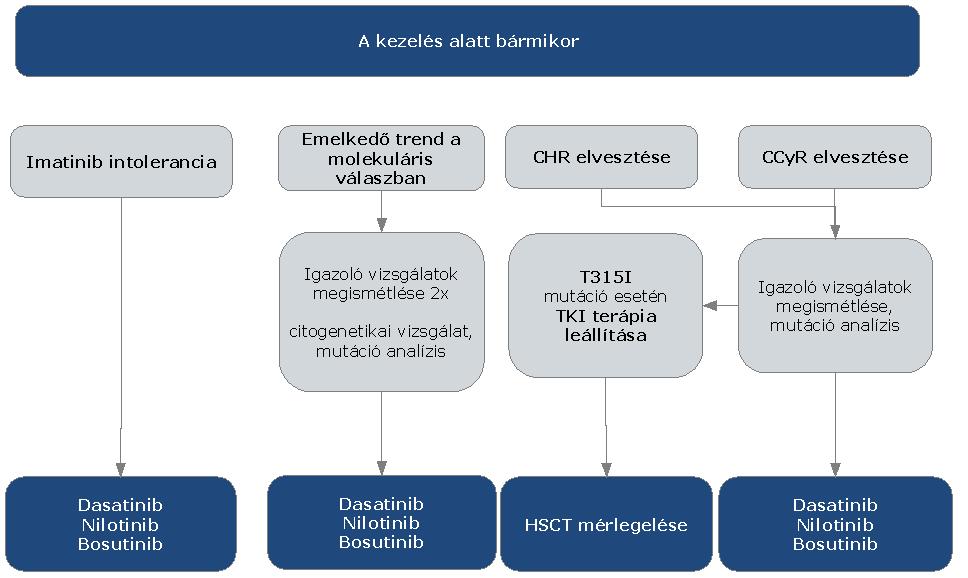
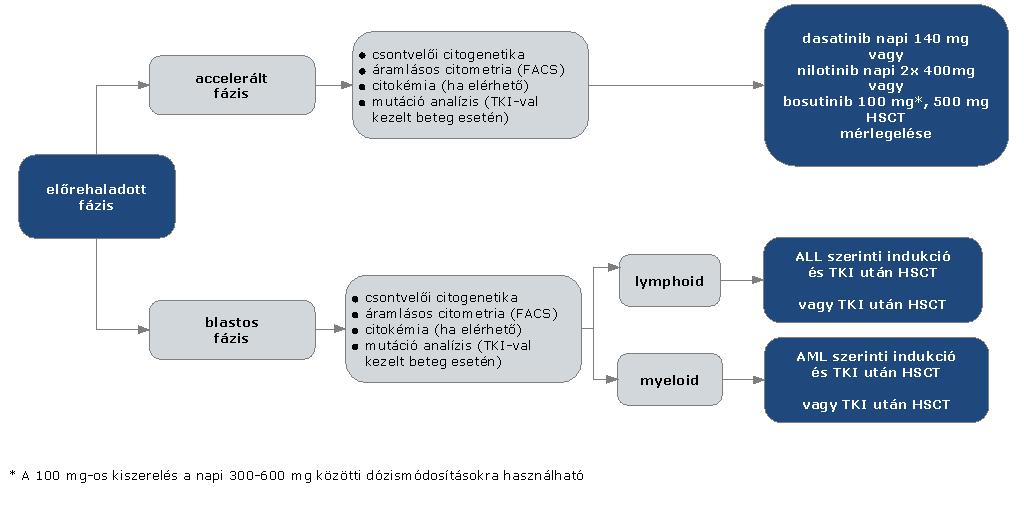
3. Finanszírozás rendje, finanszírozási algoritmus
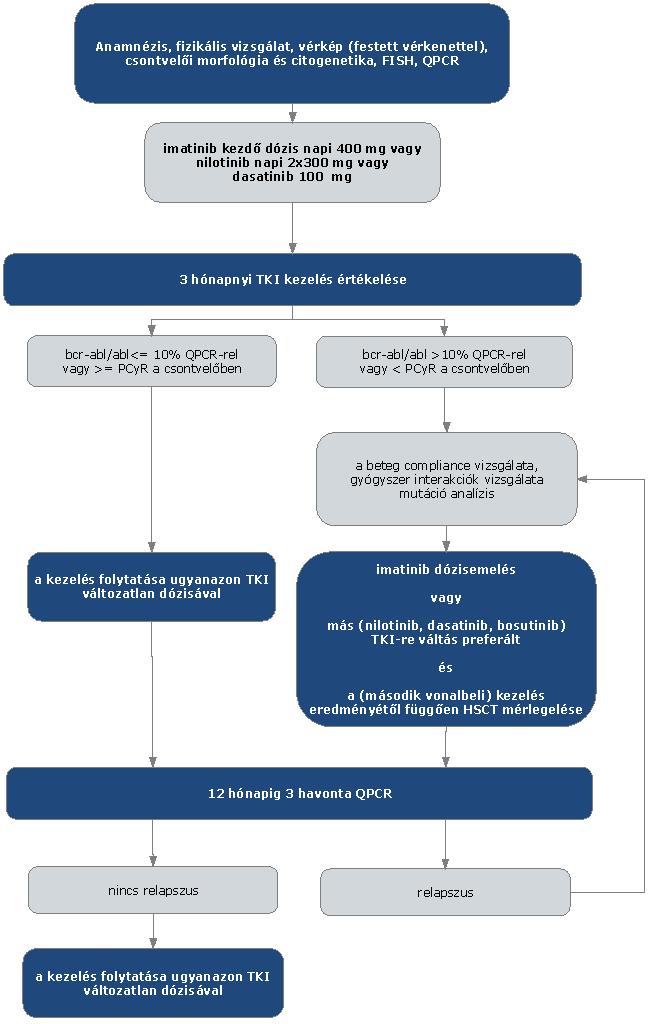
Bosutinib T315I vagy V299L BCR-ABL 1 tirozin kináz domén kimutatott pontmutációja esetén nem alkalmazható.
|
|
|
|
|
|---|---|---|---|
|
1 |
Komplett hematológiai válasz * |
Cytogenetikai válasz |
Molekuláris válasz |
|
2 |
Thrombocytaszám: <450,000/μl |
Komplett válasz: |
Major válasz: ≥ 3-log BCR–ABL (IS) mRNA csökkenés, a csökkenés mértéke alapján MR3 (3 log), MR4 (4 log) stb. |
|
3 |
Fvs<10,000/μl |
Parciális válasz: 1–35% közötti |
|
|
4 |
Quali: nincsenek jugendnél fiatalabb éretlen granulocyták, baso: <5% |
Major (komplett és parciális) |
|
|
5 |
Lép nem tapintható, nincs betegségre utaló tünet vagy jel |
Minor válasz: > 35% Ph-pozitív |
|
|
6 |
* minden paraméternek együttesen kell jelen lennie |
|
|
|
|
|
|---|---|---|---|
|
1 |
Diagnózis megállapításától eltelt idő |
Vizsgálatok |
|
|
2 |
diagnózis felállítása (0. hónap) |
csontvelői metafázis, csontvelő hiányában periferiás vér FISH vizsgálat a diagnózis igazolására |
BCR/ABL töréspont vizsgálat, BCR/ABL mRNS expressziós szint meghatározás a perifériás vérből QPCR (IS) alkalmazásával |
|
3 |
3 hónap |
csontvelői metafázis vizsgálat, ha QPCR (IS) nem érhető el a TKI-ra mutatott válasz értékelésére |
perifériás vérből QPCR (IS) |
|
4 |
ha a beteg reagál a kezelésre: 3 havonta; |
perifériás vér QPCR (IS) |
|
|
5 |
12 hónap |
csontvelői metafázis vizsgálat, ha nincs CCyR vagy MMR |
perifériás vér QPCR (IS) |
|
6 |
minden terápia-értékelésnél: |
fizikális vizsgálat, vérkép, progresszió esetén csontvelő vizsgálat |
perifériás vérből PCR-rel kináz domén mutáció analíz |
|
|
|
|
|
|
|---|---|---|---|---|
|
1 |
Diagnózis |
Célkitűzés |
Elégtelen válasz |
Teendő |
|
2 |
3 hónap |
komplett hematológiai remisszió (CHR) és BCR- ABL/ABL (QPCR) |
imatinib dózisemelés vagy |
|
|
3 |
6 hónap |
BCR-ABL/ABL (QPCR) |
BCR-ABL/ABL (QPCR) |
imatinib dózisemelés vagy |
|
4 |
12 hónap |
major molekuláris válasz |
nincs MMR |
más TKI-ra váltás (preferált), |
4. A krónikus myeloid leukémia finanszírozásának ellenőrzési sarokpontjai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. A diagnózis kritériumainak rögzítése (BNO: C9210)
Philadelphia kromoszóma pozitivitás (Ph+) vagy BCR/ABL pozitivitás igazolása
4.2.2. A betegség és a kezelés monitorizálásának ellenőrzése
4.2.2.1. Kezelésre adott válasz meghatározása, annak megfelelő dokumentálása
4.2.2.2. Remisszió, relapszus, intolerancia megfelelő dokumentálása
4.3. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
4.3.1. A területre fordított közkiadások alakulása, monitorozása
4.3.2. A finanszírozási algoritmus szerint kezelt betegek aránya
5. A finanszírozás szempontjából lényeges finanszírozási kódok
5.1. A releváns BNO kódok
|
A |
B |
|
|
1 |
BNO |
BNO megnevezés |
|
2 |
C9210 |
Krónikus myeloid leukémia |
5.2. A releváns fekvőbeteg-szakellátási kódok (HBCS és beavatkozás)
|
|
A |
B |
|---|---|---|
|
1 |
HBCs |
HBCs megnevezés |
|
2 |
770C |
Lymphoma, nem akut leukémia, legalább 14E szűrt vagy besugárzott vérkészítmény adásával |
|
3 |
54100 |
Felnőtt allogén csontvelő transzplantáció |
|
4 |
959F |
Rosszindulatú daganat kemoterápiája „F” |
|
5 |
959G |
Rosszindulatú daganat kemoterápiája „G” |
5.3. A releváns ATC kódok
|
|
A |
B |
|---|---|---|
|
1 |
ATC |
ATC megnevezés |
|
2 |
L01XE01 |
Imatinib |
|
3 |
L01XE06 |
Dasatinib |
|
4 |
L01XE08 |
Nilotinib |
|
5 |
L01XE14 |
Bosutinib |
6. Rövidítések:
6.1. ATC: Anatomical Therapeutic Chemical klasszifikáció
6.2. BNO: Betegségek nemzetközi osztályozása
6.3. CHR: Teljes hematológiai válasz
6.4. FISH: Fluorescens in situ hibridizáció
6.5. QPCR: Mennyiségi valós idejű PCR, nemzetközi skála (IS) használatával
6.6. PCyR: Részleges citogenetikai válasz
6.7. CyR: Citogenetikai válasz
6.8. CCyR: Komplett citogenetikai válasz
6.9. HBCS: Homogén betegségcsoport
6.10. HSCT: Haemopoetikus őssejt-transzplantáció
6.11. OENO: Orvosi eljárások nemzetközi osztályozása
6.12. MR: Molekuláris válasz
6.13. MMR: Major molekuláris válasz
6.14. TKI: Tirozin kináz inhibitor
2. melléklet a 31/2010. (V. 13.) EüM rendelethez14
T |
Primer tumor |
TX |
Primer tumor nem ítélhető meg |
T0 |
Primer tumor nem mutatható ki |
T1 |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában maximum 7 cm |
T1a |
4 cm-es vagy kisebb tumor |
T1b |
4 cm-nél nagyobb, 7 cm-nél nem nagyobb tumor |
T2a |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t, de 10 cm-nél nem nagyobb |
T2b |
A tumor 10 cm-nél nagyobb, de a vese anatómai határait nem haladja meg |
T3 |
A tumor ráterjed a nagyobb vénákra [vena renális(ok)], vagy közvetlenül infiltrálja a mellékvesét vagy a perirenalis (más szóval perinephriticus) szöveteket, de nem terjed túl a Gerota-fascián |
pT3a: a daganat szabad szemmel látható módon a v. renalis-ban, vagy annak nagy szegmentális ágaiban terjed (szövettan: a venának van izmos fala), vagy a perinephricus és/vagy a vesemedencei zsírszövetbe terjed; pT3b: a daganat szabad szemmel észlelhetően beterjed a v. cava-ba, de a növedék nem haladja meg a rekeszizom szintjét; pT3c: a daganat szabad szemmel észlehetően beterjed a v. cava-ba, és a növedék a rekeszizom vonalát meghaladja, vagy a tumor beszűri a v. cava falát. |
|
T4 |
pT4 stádium: a tumor túlterjed a Gerota-fascián vagy folyamatos terjedés révén beszűri a mellékvesét. |
N |
Regionális nyirokcsomók |
NX |
Regionális nyirokcsomóáttét nem igazolható |
N0 |
Nincs regionális nyirokcsomóáttét |
N1 |
Metastasis szoliter regionális nyirokcsomóban |
N2 |
Metastasis egynél több regionális nyirokcsomóban |
M |
Távoli áttétek |
M0 |
Távoli áttét nincs |
M1 |
Távoli áttét(ek) |
G |
Szövettani grading Sejtmag mérete, Sejtmag alakja, Nucleolus |
G1 |
Jól differenciált, kicsi (10 µm) Szabályos, Nem észlelhető |
G2 |
Mérsékelten differenciált, kicsi; valamivel nagyobb (15 µm) szabálytalan, 40x nagyításnál megfigyelhető |
G3 |
Gyengén differenciált, közepesen nagy (20 µm) szabálytalan, 10x nagyításnál megfigyelhető |
G4 |
Differenciálatlan, nagy (>20 µm) bizarr, feltűnő |
OENO |
OENO megnevezése |
11041 |
Vizsgálat |
36135 |
Vese UH vizsgálata |
36130 |
Hasi, kismedencei UH (áttekintő, komplex) UH vizsgálat |
34450 |
Teljes has CT vizsgálata natív |
31310 |
Mellkasfelvétel, AP/PA |
31311 |
Mellkasfelvétel, oldalirányú |
31312 |
Mellkasfelvétel, kétirányú |
31380 |
Mellkasfelvétel, célzott |
3617D |
Duplex UH, vese |
34454 |
Teljes has és medence CT vizsgálata natív és iv. kontrasztanyag adását követőleg |
34442 |
Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
34935 |
Teljes has MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
3532G |
Vese angioszcintigráfia (indokolt esetben) |
3533A |
3 fázisú csontszcintigráfia (indokolt esetben) |
34410 |
Agykoponya natív CT vizsgálata (agyi metasztázis tünetek esetén) |
35240 |
Vese szcintigráfia |
HBCS |
HBCS megnevezése |
566C |
Vese, ureter, húgyhólyag jelentős műtétei daganat miatt |
577B |
Vese-, húgyúti daganatok |
9430 |
Sugárterápia |
608Z |
Vese-, húgyutak műtétei (kivéve: jelentős műtétek) súlyos társult betegséggel |
ATC |
ATC megnevezése |
L01XE05 |
sorafenib |
L01XE04 |
sunitinib |
L01XE09 |
temsirolimus |
L03AB04 |
interferon alfa-2 |
L01XE10 |
everolimus |
L01XE11 |
pazopanib |
L01XE17 |
axitinib |
L01XE26 |
cabozantinib |
L01XC17 |
nivolumab |
3. melléklet a 31/2010. (V. 13.) EüM rendelethez15
|
T |
Primer tumor |
|---|---|
|
TX |
Primer tumor nem ítélhető meg |
|
T0 |
Primer tumor nem mutatható ki |
|
T1 |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában maximum 7 cm |
|
T1a |
4 cm-es vagy kisebb tumor |
|
T1b |
4 cm-nél nagyobb, 7 cm-nél nem nagyobb tumor |
|
T2 |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t |
|
T2a |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t, de 10 cm-nél nem nagyobb |
|
T2b |
A tumor 10 cm-nél nagyobb, de a vese anatómai határait nem haladja meg |
|
T3 |
A tumor ráterjed a nagyobb vénákra [vena renalis(ok)], infiltrálja a perirenalis (más szóval perinephricus) szöveteket, de nem terjed túl a Gerota-fascián és nem infiltrálja a mellékvesét |
|
pT3a |
A daganat szabad szemmel látható módon a v. renalis-ban, vagy annak nagy szegmentális ágaiban terjed (szövettan: a venának van izmos fala), vagy a perinephricus, illetve a vesemedencei zsírszövetbe terjed |
|
pT3b |
A daganat szabad szemmel észlelhetően beterjed a v. cava-ba, de a növedék nem haladja meg a rekeszizom szintjét |
|
pT3c |
A daganat szabad szemmel észlehetően beterjed a v. cava-ba, és a növedék a rekeszizom vonalát meghaladja, vagy a tumor beszűri a v. cava falát |
|
pT4 |
A tumor túlterjed a Gerota-fascián (ideértve, ha közvetlen terjedés révén beszűri a mellékvesét) |
|
N |
Regionális nyirokcsomók |
|
NX |
Regionális nyirokcsomóáttét nem igazolható |
|
N0 |
Nincs regionális nyirokcsomóáttét |
|
N1 |
Metastasis szoliter regionális nyirokcsomóban |
|
N2 |
Metastasis egynél több regionális nyirokcsomóban |
|
M |
Távoli áttétek |
|
M0 |
Távoli áttét nincs |
|
M1 |
Távoli áttét(ek) |
|
G |
Szövettani grading |
|||
|
Fuhrmann Grádus |
Sejtmag mérete |
Sejtmag alakja |
Nucleolus |
|
|
G1 |
Jól differenciált |
Kicsi (10 um) |
Szabályos |
Nem észlelhető |
|
G2 |
Mérsékelten differenciált |
Kicsi; valamivel nagyobb (15 um) |
Szabálytalan |
40x nagyításnál megfigyelhető |
|
G3 |
Gyengén differenciált |
Közepesen nagy (20 um) |
Szabálytalan |
10x nagyításnál megfigyelhető |
|
G4 |
Differenciálatlan |
IV Nagy |
Bizarr |
Feltűnő |
|
|
A |
B |
|
1 |
BNO |
BNO megnevezése |
|
2 |
C64H0 |
A vese rosszindulatú daganata, kivéve a vesemedencét |
|
|
A |
B |
|---|---|---|
|
1 |
OENO |
OENO megnevezése |
|
2 |
11041 |
Vizsgálat |
|
3 |
36135 |
Vese UH vizsgálata |
|
4 |
36130 |
Hasi, kismedencei UH (áttekintő, komplex) UH vizsgálat |
|
5 |
34450 |
Teljes has CT vizsgálata natív |
|
6 |
31310 |
Mellkasfelvétel, AP/PA |
|
7 |
31311 |
Mellkasfelvétel, oldalirányú |
|
8 |
31312 |
Mellkasfelvétel, kétirányú |
|
9 |
31380 |
Mellkasfelvétel, célzott |
|
10 |
3617D |
Duplex UH, vese |
|
11 |
34454 |
Teljes has és medence CT vizsgálata natív és iv. kontrasztanyag adását követőleg |
|
12 |
34442 |
Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
|
13 |
34935 |
Teljes has MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
|
14 |
3532G |
Vese angioszcintigráfia (indokolt esetben) |
|
15 |
3533A |
3 fázisú csontszcintigráfia (indokolt esetben) |
|
16 |
34410 |
Agykoponya natív CT vizsgálata |
|
17 |
34411 |
Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
|
18 |
34412 |
Agykoponya CT vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
|
19 |
14810 |
Biopsia parietis abdominis |
|
20 |
Laborvizsgálatok |
|
|
A |
B |
|---|---|---|
|
1 |
Kód |
Kemoterápiás protokoll megnevezése |
|
2 |
7051 |
Kemoterápia, GEM+CDDP I. protokoll szerint |
|
3 |
7316 |
Kemoterápia, VIP/J Carboplatinnal protokoll szerint |
|
4 |
7317 |
Kemoterápia, CMV protokoll szerint |
|
5 |
7318 |
Kemoterápia, INF-alfa+IL2+5FU protokoll szerint |
|
6 |
7320 |
Kemoterápia, GEM+CBP/C protokoll szerint |
|
7 |
7727 |
Kemoterápia, SIVD2+dexrazoxane protokoll szerint 18 év alatt |
|
8 |
7728 |
Kemoterápia, SCErV+dexrazoxane protokoll szerint 18 év alatt |
|
9 |
7729 |
Kemoterápia, WTVAER+dexrazoxane protokoll szerint 18 év alatt |
|
10 |
7744 |
Kemoterápia, WTVER+dexrazoxane protokoll szerint 18 év alatt |
|
11 |
7913 |
Immunterápia, VBL+interferon protokoll szerint |
|
12 |
7948 |
Kemoterápia, SV protokoll szerint 18 év alatt |
|
13 |
7949 |
Kemoterápia, SVA protokoll szerint 18 év alatt |
|
14 |
7950 |
Kemoterápia, SIVA2 protokoll szerint 18 év alatt |
|
15 |
7951 |
Kemoterápia, SIVD2 protokoll szerint 18 év alatt |
|
16 |
7952 |
Kemoterápia, SIVA3 protokoll szerint 18 év alatt |
|
17 |
7953 |
Kemoterápia, SCErV protokoll szerint 18 év alatt |
|
18 |
7954 |
Kemoterápia, SI3VE protokoll szerint 18 év alatt |
|
19 |
7955 |
Kemoterápia, SICARE5 protokoll szerint 18 év alatt |
|
20 |
7956 |
Kemoterápia, WV protokoll szerint 18 év alatt |
|
21 |
7957 |
Kemoterápia, WVAct protokoll szerint 18 év alatt |
|
22 |
7958 |
Kemoterápia, WTVA5 protokoll szerint 18 év alatt |
|
23 |
7959 |
Kemoterápia, WTVA5V protokoll szerint 18 év alatt |
|
24 |
7960 |
Kemoterápia, WTVER protokoll szerint 18 év alatt |
|
25 |
7961 |
Kemoterápia, WTVAER protokoll szerint 18 év alatt |
|
|
A |
B |
|---|---|---|
|
1 |
HBCS |
HBCS megnevezése |
|
2 |
566B |
Vese, ureter, húgyhólyag jelentős műtétei daganat miatt, cystectomiaval és hó-lyagpótlással |
|
3 |
566C |
Vese, ureter, húgyhólyag jelentős műtétei daganat miatt |
|
4 |
577B |
Vese-, húgyúti daganatok |
|
5 |
9430 |
Sugárterápia |
|
6 |
608Z |
Vese-, húgyutak műtétei (kivéve: jelentős műtétek) súlyos társult betegséggel |
|
7 |
610Z |
Vese-, húgyúti betegségek (kivéve: veseelégtelenség, a vese, húgyutak egyéb belgyógyászati betegségei cytostatikus vagy cyclosporin kezeléssel) |
|
8 |
959A-959H, 959 J |
Rosszindulatú daganat kemoterápiája "A"-"H" és "J" |
4. melléklet a 31/2010. (V. 13.) EüM rendelethez16
|
|
A |
B |
|
1 |
Előny |
Hátrány |
|
2 |
gyors haemoglobin emelkedés |
transzfúziós reakciók |
|
3 |
gyorsan csökken a beteg kimerültség érzése |
kongesztív szívelégtelenség |
|
4 |
fertőzések átvitele |
|
|
5 |
vastúlterhelés |
|
|
6 |
fokozott thromboemboliás készség |
|
|
7 |
csökkenő túlélés |
|
|
A |
B |
|
1 |
Előny |
Hátrány |
|
2 |
transzfúziós igény csökken |
thrombotikus szövődmények |
|
3 |
fokozatosan csökken a beteg kimerültség érzése |
csökken a túlélés |
|
4 |
a tumor progressziójáig eltelt idő csökken |
|
|
5 |
hipertenzió/zavartság |
|
|
6 |
tiszta vörösvérsejt aplázia (PRCA) |
|
|
A |
B |
|---|---|---|
|
1 |
OENO |
OENO megnevezés |
|
2 |
11041 |
Vizsgálat |
|
3 |
11301 |
Kontrollvizsgálat, konzílium |
|
4 |
29000 |
Szövettani vizsgálat szokásos feldolgozási módszerrel |
|
5 |
29050 |
Szövettani vizsgálat immunhisztokémiai reakció alkalmazása esetén |
|
6 |
14251 |
Biopsia medullae ossealis crista ossis ilei |
|
7 |
3523B |
Áttekintő csontszcintigráfia |
|
8 |
2640N |
CD pozitív sejtszám meghatározása, antigénenként, áramlási citométerrel, egyéb fluorophorral jelölt antitesttel |
|
9 |
2640L |
CD pozitív sejtszám meghatározása, antigénenként, áramlási citométerrel, FITC-el jelölt antitesttel |
|
10 |
2640M |
CD pozitív sejtszám meghatározása, antigénenként, áramlási citométerrel, phycoerithreinnel jelölt antitesttel |
|
11 |
66343 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpenzió |
|
12 |
66290 |
Vörösvérsejt koncentrátum határréteg szegény, reszuszpendált, szerelékkel |
|
13 |
64125 |
Vörösvérsejt koncentrátum zárt rendszerben mosott, fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
|
14 |
66290 |
Vörösvérsejt koncentrátum határréteg szegény, reszuszpendált, szerelékkel |
|
15 |
66343 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt és mosott kb. 50 ml, adenin tartalmú oldatban, reszuszpendált, szerelékkel |
|
16 |
66344 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, kb. 50 ml, adenin tartalmú oldatban, reszuszpendált, szerelékkel |
|
17 |
66348 |
Vörösvérsejt koncentrátum, 1 E gépi aferezis, adenin tartalmú oldatban reszuszpendált, szerelékkel |
|
18 |
66992 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, mosott fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
|
19 |
66993 |
Vörösvérsejt koncentrátum, fagyasztott, -196 °C, felolvasztott, szerelékkel |
|
20 |
69971 |
Vörösvérsejt koncentrátum, szűrt, fagyasztott, -196 °C, szerelékkel |
|
21 |
69972 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpendált, szerelékkel |
|
22 |
64125 |
Vörösvérsejt koncentrátum, zárt rendszerben mosott, fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
|
23 |
37008 |
Konformális besugárzás kiegészítő pontja |
|
24 |
37220 |
Lineáris accelerátor, foton 16 MV és a felett, egy mező |
|
25 |
37210 |
Lineáris accelerátor, foton 7-15 MV és a felett, egy mező |
|
26 |
37200 |
Lineáris accelerátor, foton 6 MV-ig, egy mező |
|
27 |
37007 |
Irreguláris mezős besugárzás kiegészítő pontja, egy mező |
|
28 |
3586A |
Pótlék: egy testtájék kiegészítő SPECT vizsgálat |
|
29 |
28939 |
Fluoreszcencia insitu hibridizáció (FISH) humán betegségekben |
|
30 |
26625 |
CA 125 |
|
31 |
29400 |
Diagnosztikus aspirációs/exfoliatív citológiai vizsgálat a szokásos feldolgozási módszerrel |
|
32 |
36130 |
Hasi (áttekintő, komplex) UH vizsgálat |
|
33 |
31312 |
Mellkasfelvétel, kétirányú |
|
34 |
31310 |
Mellkasfelvétel, AP/PA |
|
|
A |
B |
|---|---|---|
|
1 |
HBCS |
HBCS megnevezés |
|
2 |
9511-15 |
Radiokemoterápia "A"; "B"; "C"; "D"; "E" |
|
3 |
959A-L |
Rosszindulatú daganat kemoterápiája "A"; "B"; "C"; "D"; "E"; "F"; "G"; "H"; "I"; "J"; "K"; "L" |
|
4 |
7720 |
Akut leukémiák magas malignitással, kemoterápiával és legalább 25 E szűrt vagy besugárzott vérkészítmény adásával 18 év alatt |
|
5 |
773A-K |
Akut leukémiák nagy dózisú vagy standard kemoterápiával, (…) szűrt vagy besugárzott vérkészítmény adásával |
|
6 |
944A |
Hodgkin-kór, non-Hodgkin lymphoma, nem akut leukémia kemoterápiája 18 év felett legalább 14E szűrt és besugárzott vérkészítmény adásával |
|
7 |
944C |
Hodgkin-kór, non-Hodgkin lymphoma, nem akut leukémia kemoterápiája, legalább 7E szűrt vagy besugárzott vérkészítmény adásával |
|
8 |
950F |
Hodgkin-kór kemoterápiája 18 év felett |
|
9 |
950H |
Hodgkin-kór, non-Hodgkin lymphoma, nem akut leukémia kemoterápiája 18 év felett, legalább 14E szűrt vagy besugárzott vérkészítmény adásával |
|
10 |
945A |
Non-Hodgkin lymphoma, nem akut leukémia kemoterápiája 18 év felett |
|
11 |
086D |
Fej-, nyaktájék egyéb nagyobb műtétei rosszindulatú daganat miatt |
|
12 |
1010 |
Fül, orr, száj, garat, gége rosszindulatú daganatai |
|
13 |
1460 |
Légzőszervi daganatok |
|
14 |
506C |
Rosszindulatú emlődaganatok |
|
15 |
539C |
Rosszindulatú endokrin daganatok |
|
16 |
621C |
Férfi reproduktív rendszer rosszindulatú daganatai |
|
17 |
577B |
Vese-, húgyúti daganatok |
|
18 |
657C |
Női reproduktív rendszer rosszindulatú daganatai |
|
19 |
6420 |
Uterus-, adnex műtétek malignitás miatt |
|
A |
B |
|
|
1 |
ATC |
ATC megnevezés |
|
2 |
B03XA01 |
Eritropoietin, epoetin alfa, epoetin theta, epoetin zéta |
5. melléklet a 31/2010. (V. 13.) EüM rendelethez17
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Neurodegeneratív megbetegedések:
1.1. G20HO Parkinson-kór
1.2. G2110 Egyéb, gyógyszer-indukálta másodlagos parkinsonismus
1.3. G2120 Más külső tényező okozta másodlagos parkinsonismus
1.4. G2130 Agyvelőgyulladás utáni parkinsonismus
1.5. G2180 Egyéb másodlagos parkinsonismus
1.6. G2190 Másodlagos parkinsonizmus k.m.n.
2. Fogalmak
2.1. A szintű bizonyíték: Az adott beavatkozás hatásossága egyértelműen bizonyított („hatásos”). Azaz: legalább egy I. szintű vagy legalább két II. szintű vizsgálat egybehangzó eredménye támasztja alá.
2.2. B szintű bizonyíték: Az adott beavatkozás hatásossága valószínűen hatásos. Azaz: legalább egy II. szintű vagy legalább három III. szintű vizsgálat egybehangzó eredménye támasztja alá.
2.3. C szintű bizonyíték: Az adott beavatkozás hatásossága/nem hatásossága lehetséges. Azaz legalább két III. szintű vizsgálat meggyőző és egybehangzó eredménye támasztja alá.
2.4. Bradykinézia/hypokinézia: A mozgás sebességének, amplitúdójának csökkenése, a mozgás indítás és leállítás és a program váltás megnehezülése. A Parkinson-kór diagnózisának egyik alappillére.
2.5. Disztónia: Akarattól független izom összehúzódás, amely tartászavart hoz létre (pl. tortikollis, OFF-disztónia: az öregujj dorzalflexiója, stb.), gyakran komoly fájdalommal jár, diszkinézissel ötvöződhet.
2.6. Diszkinézis: akarattól független, ismétlődő, irreguláris izommozgás (pl. a végtagokban korea, a törzsön atetózis formájában, disztóniával ötvöződhet).
2.7. Életminőség: A beteg utóbbi 3 életévére vonatkozóan, a személyére szabott kezelés megítélésére kialakított fogalom. A beteg állapotának önértékelő teszt segítségével való értékelését teszi lehetővé, értékes módon kiterjeszti a célzott anamnézis felvételének értelmét, célszerűen egészíti ki az UPDRS, illetve az MDS-UPDRS skálákat. Hazánkban több teszt is validált, alkalmazható (pl. PDQ-39).
2.8. Ergot derivátum: Növényből kivont dopamin agonista hatású gyógyszerkészítmény. Retroperitoneális, pleuropulmonális és kardiális valvuláris fibrózist okozhat. Alkalmazása során félévenként transztorakális szív ultrahang vizsgálat kötelező.
2.9. Fluktuáció: A betegség súlyosbodása során a korábban egész nap hatásos gyógyszeres kezelés hatása egyenetlenné válik. Az egyik típusa a hatáscsökkenés-dózis lecsengés (Wearing-off, WO) és a rossz mozgásteljesítménnyel járó állapot (OFF), melyhez disztónia kapcsolódhat, a másik a dózis időbeli csúcshatásához kapcsolódó, akarattól független mozgások (csúcsdózis diszkinézia, ON-diszkinézia). A kórlefolyás során a WO és az OFF általában megelőzi a csúcsdózis diszkinézia jelentkezését. A fluktuáció a kétféle állapot egymást követő váltakozását jelenti. A fluktuáció kialakulásában a kezelés kizárólagos szerepe egyértelműen nem bizonyított.
2.10. Freezing: „Lefagyás”. A mozgás, a mozgáskoordináció hirtelen, váratlan zavara, leállása.
2.11. Késői Parkinson-kór/betegség: Késői Parkinson-kórról a motoros komplikációk megjelenése után beszélünk.
2.12. Komorbid betegségek: A Parkinson-kórhoz kapcsolódó bármely betegség. A betegség lefolyása során bármikor fontos ezek felismerése és mérlegelésük a terápiában. Különösen fontos a pszichiátriai betegségek elkülönítése és kezelése.
2.13. Komplex nem-motoros tüneti szindróma: A motoros tüneteket több évvel megelőző tünetegyüttes, amely a betegség megjelenésére utal/prognosztizálja: székrekedés, szaglászavar, hangulati élet elcsendesedése - hangulatzavar, alvászavar, nyálfolyás, vizelettartási zavar, egyoldali vállfájdalom, szürkületi látás problémák.
2.14. Motoros tünetek: A bazális ganglionok működészavara által kiváltott mozgató rendszeri tünetek. Ezek a Brit Agybank kritériumrendszere alapján meghatározott fő mozgás zavar típusok és a hozzájuk kapcsolódó másodlagos mozgatórendszeri tünetek együttesen.
2.15. Nem motoros tünetek: A beteg életminőségét a motoros tüneteknél is markánsabban meghatározó összes eltérés: kognitív, hangulati, magatartási, érzőrendszeri, fájdalmi, autonóm idegrendszeri, gasztrointesztinális jellegű panaszcsoportok és vizsgálható eltérések. Ezek egy része megelőzi a motoros tüneteket. Számuk szaporodik a betegség lefolyása során, és a motoros fluktuációkhoz kapcsolódva még erőteljesebbek lesznek.
2.16. Nyugalmi tremor: A végtagok, az ajak, a nyelv, a szempilla oszcilláló, ritmusos, akarattól független mozgása, amely a testrész akaratlagos innervációtól mentes állapotában észlelhető, és akaratlagos mozgás során megszűnik. A Parkinson-kór diagnózisának másik, lehetséges motoros alappillére. A betegek egy részében mozgásra aktiválódó végtag komponensek lehetnek.
2.17. On-off jelenség: Motoros komplikáció. A gyógyszeres kezelés hatására csökkennek a Parkinson-kór tünetei, azonban a hatóanyag koncentrációja az agyban nem állandó. Amikor a szint alacsony, a tünetek erősebbek (off fázis). Az off és on fázis váltakozása jelenleg együtt jár a Parkinson-kórral, és a hosszú távú levodopa kezelés után az ingadozás kiszámíthatatlanabbá válik.
2.18. Parkinsonizmusok: A Parkinson-kórtól (betegségtől) elkülöníthető, de hasonló tünetekkel rendelkező kórismék.
2.19. Parkinson-kór (PK): A hazai szakmai nyelvhasználat alapján az (Idiopátiás) Parkinson-szindróma, amely az eljárásrendben részletesen leírásra került, amely a leírásra kerülő terápiákkal tünetileg egyértelműen kezelhető (angolszász forrásokban: Parkinson’s Disease).
2.20. Parkinson-kór előrehaladott szakasza: A motoros komplikációk azon szakasza, mely során a beteg életminősége nem tartható fenn a komplex gyógyszeradagolás egyénre szabott módszereivel, a súlyos tünetek és az állapot kifejezett, permanens változékonysága csak speciális kezelési eljárások alkalmazásával biztosítható. Ez a szakasz a beteg haláláig tart. A kezelés indikációja, esetleges leállítása a beteg belegyezése és neurológus által vezetett munkacsoport döntésén alapszik.
2.21. Parkinson-kór korai szakasza: A motoros tünetek megjelenésétől a motoros fluktuációk megjelenéséig (diagnosztikus kritériumok alapján felállított diagnózis).
2.22. Parkinson-kór motoros komplikációk szakasza: A motoros fluktuációk kezdetétől a betegség előrehaladott fázisán át a beteg haláláig tartó szakasz.
2.23. Parkinson-szindrómák (PSZ): Ezen betegségekben a Parkinson-kórra jellemző neurológiai gócjelekhez (parkinzonizmus tünetei) egyéb, a beteg sorsát döntően meghatározó neurológiai eltérések kapcsolódnak a betegség kezdetétől, máskor későbbi szakaszában. Ezen betegségek patomechanizmusa egyes esetekben teljesen eltér a Parkinson-kórban ismertektől. Ezen betegségek tünetei kismértékben vagy nem reagálnak a klasszikus dopaminerg terápiára.
2.24. RBD (REM alvás magatartás zavar): Az alvás REM fázisát nem a szokásos tónustalanság jellemzi, hanem folyamatos mozgások, testhelyzetváltozások, hangadás, kiabálás, ágyról való leesés, ágynemű összegyűrése és az ezzel járó kellemetlen tartalmú álmok.
2.25. Rigor: Az izomzat nyugalomban is fennálló, sokszor fájdalmas feszülése, amely egyaránt érinti a végtagok agonista és antagonista izmait. A Parkinson-kór diagnózisának másik alappillére lehet.
2.26. Tremor: Nyugalmi remegés. A Parkinson-kór motoros alaptünete.
2.27. Wearing-off állapot: A dopaminerg gyógyszerhatás (levodopa, dopamin agonista) visszatérő, gyógyszerbevételektől függő formája és a hatástalanság megjelenését jelenti: a már hatékonyan kezelt motoros és nem-motoros tünetek igen kifejezetten visszatérnek. Hatáscsökkenés esetén egyenletesen, míg dózisvégi csökkenés esetén a következő bevett gyógyszer adag hatása jelentkezéséig. Különleges OFF-állapotok is vannak: a hatáskésés (Delayed-ON): a „szokásos” idő elmúltával nem jelentkezik a hatás, csak később; hatás elmaradás (No-ON): a gyógyszerbevétel ellenére nincs hatás.
2.28. „Red Flag”: Olyan panasz és neuropsychiátriai jelenség, gócjel, amely a betegség korai szakaszában jelzi a vizsgálónak, hogy Parkinson-szindróma valószínű és nem Parkinson-kór.
3. Kórkép leírása
3.1. A Parkinson-kór gyakori, progresszív neurodegeneratív betegség, amelyben az idegrendszerben a substantia nigra dopaminerg neuronjainak degenerációja miatt a dopamin-szint leesik. A dopamin a szervezetben a neuronok közötti ingerület-átvitelért felelős, így a szint csökkenése az idegsejtek közötti kommunikációt akadályozza.
3.2. A Parkinson-kór a mozgászavarokhoz tartozó neuropsychiátriai betegség. A betegség diagnózisa ma is klinikai és két ún. pillértüneten nyugszik: az egyik mindenképpen a bradykiézia/hypokinézia (a mozgás program lassúsága), míg a másik pillértünet lehet a rigor (merevség) vagy a nyugalmi tremor (végtag, ajak, pilla akarattól független, azaz nyugalmi ritmikus mozgása), vagy mind a kettő. A negyedik főtünet a betegség előrehaladott szakaszában jelentkezik, ez a tartási instabilitás. Előfordulhat a betegség kezdetén tremor domináns klinikai forma, ennek diagnózisa nehezebb.
3.3. Parkinson-kórban a motoros tüneteken kívül nagy jelentőségük van a nem-motoros tüneteknek is: pszichológiai problémák, demencia, a későbbiekben autonóm zavarok. A betegség előrehaladott fázisban komoly fogyatékossághoz, rokkantsághoz vezet, nagymértékű életminőség-csökkenést okoz.
3.4. A Parkinson-kór prevalenciája 200-400 fő/100 000 lakosra, Magyarországon a betegszám megközelítőleg 20 000 fő, a betegek 50-70%-a áll kezelés alatt. Jelenleg az évi incidencia 8-10/100 000 lakos, de az arány folyamatosan növekszik.
4. Finanszírozás rendje, finanszírozási algoritmus
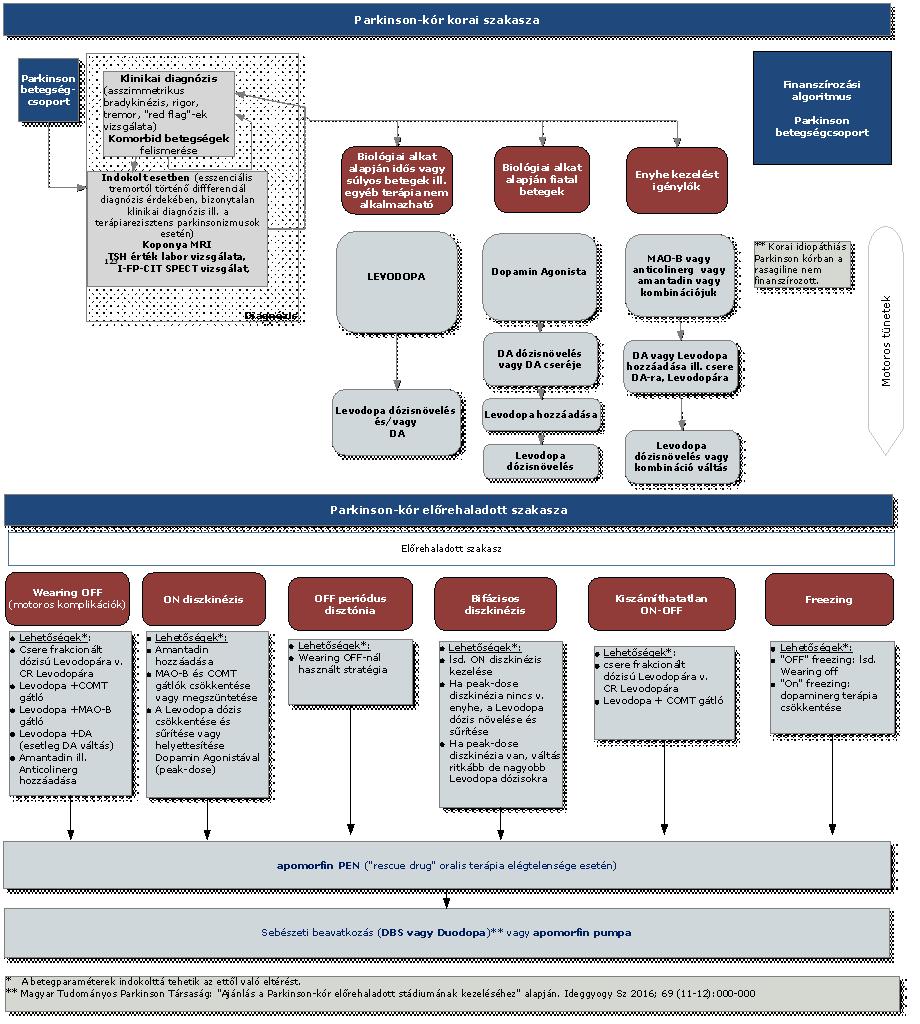
5. A Parkinson betegség ellátására vonatkozó emelt, indikációhoz kötött támogatás:
5.1. EÜ90 6/a. Támogatott indikációk:
Parkinson-kór és Parkinson-szindróma (másodlagos parkinsonismus) kezelésére – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.1.1. amantadine
5.1.2. biperiden
5.1.3. levodopa, benserazide hydrochloride
5.1.4. procyclidine
5.1.5. selegiline
5.2. EÜ90 6/b. Támogatott indikációk:
Parkinson-kór esetén, az alkalmazási előírásban szereplő monoterápiában, L-DOPA és selegilinnel, illetve amantadinnal való kombinált kezelésben kiegészítő kezelésként is, ha súlyos motoros fluktuáció jelentkezik – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.2.1. pramipexole
5.2.2. rasagiline
5.2.3. ropinirole
5.2.4. rotigotine
5.3. EÜ90 6/c. Támogatott indikációk:
Parkinson-kórban kialakuló motoros fluktuáció minden esetében – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.3.1. entacapone
5.3.2. levodopa, carbidopa, entacapone
5.3.3. safinamide.
5.4. A motoros hullámzások („on-off” jelenség) kezelése olyan Parkinson-kórban szenvedő betegeknél, akik nem kezelhetők kielégítő módon a szájon át adott anti-Parkinson készítménnyel - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.4.1. Apomorfin-hidroklorid-hemihidrát pen („rescue drug”) alkalmazható optimálisan beállított, de elégtelen oralis terápia mellett:
- a megjósolható motoros és nem - motoros OFF periódusok gyors megelőzésére,
- hirtelen vagy akut OFF periódus gyors megszüntetésére,
- ha az oralis levodopa feszívódása zavart vagy gyomor ürülési problémák (gasztroparesis) esetén,
- a késve jelentkező gyógyszerhatás („delayed on”) vagy a kimaradó gyógyszerhatás („no on”) kezelésére a gyomor motilitással, ürüléssel összefüggésben,
- hajnali vagy kora reggeli akinesia és dystonia megoldására.
5.5. EÜ100 65. Támogatott indikációk:
Előrehaladott Parkinson-kór esetén a Parkinson betegségcsoport diagnosztikájának és kezelésének a finanszírozási eljárásrendjében meghatározottak szerint.
5.5.1. levodopa+ carbidopa intesztinális gél
5.5.2. apomorfin-hidroklorid-hemihidrát pumpa alkalmazható:
- ha a beteg gyakran (több, mint 6 alkalom/nap) igényel pen adagot,
- ha zavaró dyskinesiák limitálják a további terápia módosítást,
- ha súlyos nem - motoros tünetek jelentkeznek „OFF”-ban,
- ha műtét (mély agyi stimuláció (DBS)) vagy levodopa+carbidopa intesztinális gél kezelés kontraindikált
- döntően nem-motoros, elsősorban neuropsychiátriai tünetek túlsúlya esetén
A terápia hatástalannak tekinthető, ha a betegség progrediált és a beteg állapota az eszközös terápiák (Duodopa, Apomorphin se. infúzió vagy Apormorphin pen) mellett a Hoehn&Yahr skála szerint 5. stádiumú. A beteg állapotát évente orvosilag dokumentálni kell.
6. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
6.2. Betegadatok (online TAJ ellenőrzés)
6.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7. Szakmai ellenőrzési pontok
7.1. A klinikai diagnózis felülvizsgálata rendszeres időközönként, fél-egyévente történik.
7.2. A diagnózis klinikai szempontrendszer szerint történik, MRI, PET-CT és CT Parkinson-szindróma differenciál diagnózisában nem kötelező, de indokolt lehet, agyi SPECT csak indokolt esetben (fent meghatározott) végzendő.
7.3. A gyógyszeres kezelés akkor kezdődhet, ha a klinikai diagnózis megszületett. A Parkinsonos tünetek egységes rendszer alapján értékelhetőek. Az UPDRS (Unified Parkinson’s Disease Rating Scale) vagy az ebből továbbfejlesztett MDS-UPDRS (Movement Disorders Society Unified Parkinson’s Disease Rating Scale) skála lehetőséget ad erre.
7.4. Anticholinerg és amantadin korai Parkinson-kórban első választású terápiaként nem alkalmazható, kivéve, ha a beteg egyéb, gyógyszer-indukálta másodlagos parkinsonismusban szenved. Ekkor anticholinerg szer adható. COMT gátló csak a fluktuációk kezdetétől adható.
7.5. Neuroprotektív céllal csak klinikai vizsgálat keretében kezelhetők a betegek.
7.6. A motoros komplikációk klinikai megállapítása után (Parkinson skálák) a beteg adjuváns terápiában részesül. Az adjuváns terápia a motoros komplikációk jellegétől és mértékétől függ.
7.7. Az ún. előrehaladott kezelési lehetőségek, mint műtéti beavatkozás csak speciális (fent meghatározott) esetekben indokolt.
7.8. Minden beteg számára hozzáférhető kell, hogy legyen a fizioterápiás kezelés, a pszichológiai és szociális kezelés/gondozás.
7.9. A Parkinson-kór diagnózisának felállításától kezdve a betegek kezelésben részesülnek a nem-motoros tünetek kontrollálására.
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. A releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
BNO |
BNO megnevezés |
|
2 |
G20H0 |
Parkinson-kór |
|
3 |
G2110 |
Egyéb, gyógyszer-indukálta másodlagos parkinsonismus |
|
4 |
G2120 |
Más külső tényezők okozta másodlagos parkinsonismus |
|
5 |
G2130 |
Agyvelőgyulladás utáni parkinsonismus |
|
6 |
G2180 |
Egyéb másodlagos parkinsonismus |
|
7 |
G2190 |
Másodlagos parkinsonismus k.m.n. |
|
8 |
Y4670 |
Antiparkinson gyógyszerek |
9.2. Releváns ATC kódok
|
|
A |
B |
|---|---|---|
|
1 |
ATC |
ATC megnevezése |
|
2 |
N04* |
Anti-parkinson gyógyszerek |
|
3 |
N04A* |
Anticholinergek |
|
4 |
N04AA |
Tercier aminok |
|
5 |
N04B* |
Dopaminergek |
|
6 |
N04BA |
Dopa és dopa derivátumok |
|
7 |
N04BB |
Adamantane derivátumok |
|
8 |
N04BC |
Dopamin agonisták |
|
9 |
N04BD |
MAO-B gátlók |
|
10 |
N04BX |
Egyéb dopaminergek (COMT-gátlók) |
9.3. Finanszírozott hatóanyagok Magyarországon
|
|
A |
B |
|---|---|---|
|
1 |
ATC |
Hatóanyag |
|
2 |
N04AA02 |
biperiden |
|
3 |
N04AA04 |
prociklidin |
|
4 |
N04BA02 |
levodopa és decarboxylase gátló |
|
5 |
N04BA03 |
levodopa, decarboxylase gátló és COMT gátló |
|
6 |
N04BB01 |
amantadin |
|
7 |
N04BC04 |
ropinirol |
|
8 |
N04BC05 |
pramipexol |
|
9 |
N04BC07 |
apomorfin-hidroklorid-hemihidrát |
|
10 |
N04BC09 |
rotigotine |
|
11 |
N04BD01 |
selegilin |
|
12 |
N04BD02 |
rasagiline |
|
13 |
N04BD03 |
safinamide |
|
14 |
N04BX02 |
entacapone |
10. Rövidítések
ATC Gyógyszerek anatómiai, terápiás, illetve kémiai osztályozása
BNO Betegségek nemzetközi osztályozása
6. melléklet a 31/2010. (V. 13.) EüM rendelethez18
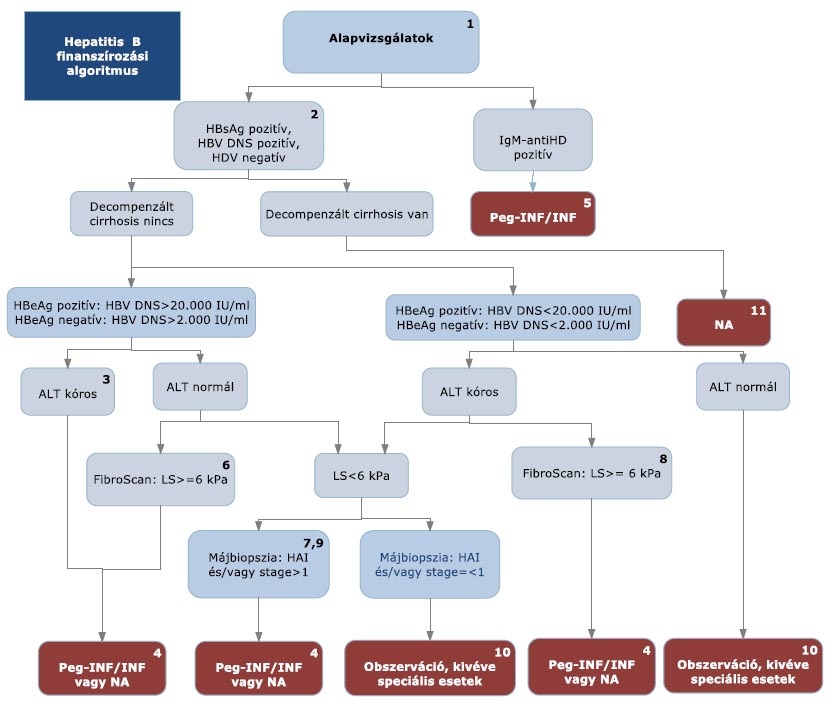
|
|
A |
B |
|
1 |
Recipiens |
Profilaxis |
|
2 |
HBsAg poz |
HBIG + entecavir |
|
3 |
anti-HBs poz és anti-HBc poz |
nem szükséges |
|
4 |
anti-HBs neg és anti-HBc poz |
entecavir |
|
5 |
anti-HBs poz és anti-HBc neg (sikeresen oltott) |
entecavir |
|
6 |
anti-HBs neg és anti-HBc neg (naiv) |
entecavir |
|
|
A |
B |
|
1 |
BNO |
BNO megnevezés |
|
2 |
B1800 |
Idült vírusos B-típusú hepatitis d-ágenssel |
|
3 |
B1810 |
Idült vírusos B-típusú hepatitis d-ágens nélkül |
|
|
A |
B |
|
1 |
OENO |
OENO megnevezés |
|
2 |
11041 |
Vizsgálat |
|
3 |
88460 |
Vérvétel |
|
4 |
99910 |
Kiegészítő pont veszélyeztető beteg ellátásáért |
|
5 |
28014 |
Vérkép automatával IV. |
|
6 |
24600 |
Aszpartát-amino-transzferáz (ASAT, GOT) meghatározása |
|
7 |
24610 |
Alanin-amino-transzferáz (ALAT, SGPT) meghatározása |
|
8 |
24640 |
Gamma-glutamil-transzferáz meghatározása |
|
9 |
24720 |
Alkalikus foszfatáz meghatározása |
|
10 |
24741 |
Pszeudo-kolineszteráz meghatározása |
|
11 |
21020 |
Összfehérje meghatározása szérumban |
|
12 |
21040 |
Albumin meghatározása szérumban, festékkötő módszerrel |
|
13 |
21310 |
Glükóz meghatározása |
|
14 |
21420 |
Összkoleszterin meghatározása |
|
15 |
21411 |
Trigliceridek meghatározása |
|
16 |
21150 |
Összes bilirubin meghatározása szérumban |
|
17 |
21151 |
Konjugált bilirubin meghatározása szérumban |
|
18 |
28620 |
Prothrombin meghatározása |
|
19 |
21120 |
Karbamid meghatározása szérumban |
|
20 |
21140 |
Kreatin meghatározása |
|
21 |
2627T |
Hepatitis C vírus AT kimutatása |
|
22 |
2639A |
HBsAg AG kimutatása |
|
23 |
2639B |
HBsAg konfirmációja |
|
24 |
2639E |
HBeAg AG kimutatása |
|
25 |
2627R |
Anti-HBc AT kimutatása |
|
26 |
2627S |
Anti-Hbe AT kimutatása |
|
27 |
24060 |
TSH meghatározása (Thyreoidea-Stimuláló Hormon) |
|
28 |
2627Q |
Anti-Hbs AT kimutatása |
|
29 |
29950 |
DNS kivonása biológiai mintából |
|
30 |
28938 |
Oligonucleotid hibridizáció membráncsíkon próbapáronként |
|
31 |
28920 |
Polimeráz láncreakció (PCR) egy mintában primer páronként |
|
32 |
2627W |
Vírus ellenes AT meghatározása ELISA módszerrel |
|
33 |
2639L |
Hepatitis B vírus mennyiségi meghatározása bDNS módszerrel |
|
34 |
25572 |
Hepatitis B vírus gyógyszer-rezisztens mutánsainak meghatározása PCR alapú módszerrel |
|
35 |
2627U |
Hepatitis-D vírus AT kimutatása |
|
36 |
2661H |
Thyreoidea-peroxidáz elleni antitest meghatározása |
|
37 |
29000 |
Szövettani vizsgálat a szokásos feldolgozási módszerrel |
|
38 |
36130 |
Hasi (áttekintő, komplex) UH vizsgálat |
|
39 |
3613D |
Tranziens elasztográfia |
|
40 |
81581 |
UH vezérelt májbiopsia |
|
41 |
81580 |
Aspiratio hepatis |
|
42 |
92231 |
Immunmoduláció |
|
43 |
91311 |
Krónikus beteg dietetikai alapoktatása (gastroenterológiai, nephrológiai, onkológiai vagy 2. típusú diabeteses betegnél) |
|
A |
B |
|
|
1 |
HBCS |
HBCS megnevezés |
|
2 |
351B |
Májbetegségek, kivéve rosszindulatú daganatok, cirrhosis |
|
|
A |
B |
|
1 |
ATC |
ATC megnevezés |
|
2 |
L03AB05 |
INF-alfa 2b |
|
3 |
L03AB11 |
peginterferon-alfa 2a |
|
4 |
L03AB04 |
INF-alfa 2a |
|
5 |
J05AF05 |
lamivudin |
|
6 |
J05AF10 |
entecavir |
|
7 |
J05AF08 |
adefovir dipivoxil |
|
8 |
J05AF07 |
tenofovir disoproxil |
7. melléklet a 31/2010. (V. 13.) EüM rendelethez19
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Felnőttkori Crohn-betegség (luminális)
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl. szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid kedvező hatásának időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, és ezáltal lehetőleg a szövődmények kialakulásának és a műtéti kezelésnek az elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel nem tudjuk megváltoztatni a betegek jelentős részében. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroidmentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A Crohn-betegség aktivitása
A Crohn-betegség súlyosságának megítélésére az eltérő betegségtípusok esetén más-más mérőszámok alkalmasak. Gyulladásos típusú betegségben a CDAI (Crohn’s Disease Activity Index) a legelterjedtebben alkalmazott aktivitási index. A CDAI alapján történő besorolást és az annak megfelelő klinikai állapotot táblázatban részletezzük. A kezelést hatékonynak tekintjük (klinikai válasz), ha a CDAI 70 ponttal csökken, 150 pont alatt remisszióról beszélünk. A csak a felső gastrointestinalis traktust érintő luminalis Crohn-betegség esetén a CDAI nem minden esetben alkalmas a klinikai állapot megítélésére. A műtéti beavatkozás során esetleg kialakított hasfali vendégnyílás (stoma) a székletszám változásán keresztül befolyásolja a CDAI értékét, így ilyenkor az csak becsülhető.
2.2. A szteroid kezelés fő problémái
2.2.1. Szteroid refrakter IBD: ha legalább 0,75 mg/ttkg prednisolon (vagy metil-prednisolon) mellett Crohn-betegség vagy colitis ulcerosa esetén 4 hét kezelés után is aktív a betegség vagy intravénásan alkalmazott 1 mg/ttkg metil-prednisolon esetén egy hét alatt nincs mérhető tüneti javulás és a CRP értéke sem normalizálódik.
2.2.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon (vagy metil-prednisolon) alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
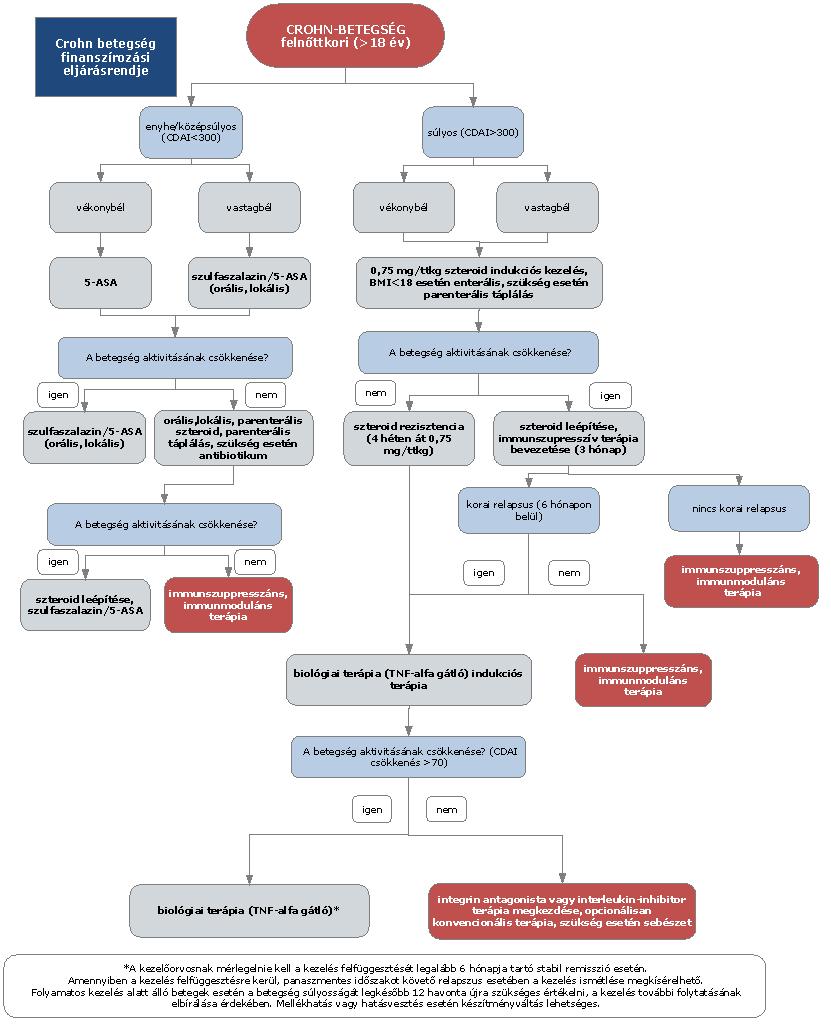
4. A felnőttkori Crohn-betegség gyógyszeres kezelési algoritmusa
4.1. Enyhe esetben alapellátásban terminális ileum érintettsége esetén budesonid, esetleg, átmenetileg 5-ASA, illetve a colon érintettsége esetén sulphasalazin kezelés megpróbálható,
4.2. kezdeti szteroid kezelés 3 hónapig,
4.3. korai immunszuppresszív terápia,
4.4. negyedik vonalban: biológiai terápia (biológiai terápia alkalmazására kijelölt intézmények); valamelyik TNF-α gátló alkalmazása: infliximab (az alkalmazott támogatási kategória figyelembevételével); adalimumab; ezek hatástalansága vagy hatásvesztés esetén integrin antagonista vedolizumab vagy interleukin inhibitor ustekinumab.
5. A Crohn-betegség biológiai kezelése
5.1. Indukciós kezelés gyulladásos típusú Crohn-betegségben (luminális): anti-TNF-α indukciós kezelés indikált bármely lokalizációban lévő középsúlyos-súlyos Crohn-betegségben (EL1a, RGB) elsővonalban, ha
5.1.1. az alkalmazott hagyományos (szteroid indukciós, majd 3 hónapos fenntartó immunszupresszív) terápia ellenére a betegség aktivitása nem csökken, vagy
5.1.2. szteroid rezisztencia esetén (4 héten át alkalmazott 0,75 mg/ttkg prednisolon ekvivalens szteroid dózisra nem reagáló), vagy
5.1.3. immunszuppresszáns kezelés (legalább 2 mg/ttkg vagy a legmagasabb tolerált dózisú azatioprin) mellett is szteroid dependencia alakul ki (3 hónapon túl szisztémásan 10 mg/nap dózisnál nagyobb prednisolon ekvivalens dózis), vagy
5.1.4. immunszuppresszáns kezelésre a beteg intoleráns, vagy
5.1.5. a hagyományos gyógykezelés toxicitása miatt nem alkalmazható a teljes indukciós kezelés időtartamáig.
5.1.6. Anti-TNF-α hatástalansága vagy hatásvesztés esetén alkalmazható másodvonalban az integrin antagonista vedolizumab vagy az interleukin inhibitor ustekinumab.
5.2. A Magyarországon jelenleg engedélyezett készítmények közül:
5.2.1. Infliximab (IFX) esetében: 5mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. Az indukciós kezelést követően 6 héten belül nem reagáló betegek további IFX-kezelését nem támasztják alá a rendelkezésre álló adatok.
5.2.2. Adalimumab (ADA) esetében: 80 mg a 0. héten, majd 40 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, a készítmény alkalmazható a 0. héten 160 mg (a dózis beadható 4 injekcióban egyetlen napon, vagy napi 2 injekcióban két egymást követő napon), a 2. héten 80 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata.
5.2.3. Vedolizumab (VEDO) 300 mg a 0., 2. és 6. héten alkalmazva. Azoknak a Crohn-betegeknek, akiknél nem mutatkozik terápiás válasz, előnyös lehet egy adag a 10. héten. Crohn-betegek esetében nem szabad folytatni a terápiát, ha a 14. hétre sem figyelhető meg terápiás előny.
5.2.4. Az ustekinumab (UST) terápiát a testtömeg alapján számított egyszeri intravénás adaggal kell elkezdeni az alkalmazási előírásban foglaltak szerint. Az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt.
5.3. A biológiai terápia hatékonyságának ellenőrzése Crohn-betegségben
5.3.1. Luminalis Crohn-betegség estében az indukciós kezelést követő (12-14. hét) legalább 70 pontos CDAI esés (reagálás) vagy a CDAI 150 pont alá esése esetében (remisszió) az indukciós kezelést hatékonynak tekintjük.
5.3.2. Szteroid dependens kórforma esetében a biológiai kezelést hatékonynak tekintjük, ha az indukciós kezelés végére a szteroid dózisa legalább a felére csökkenthető. Kombinált kórformákban bármely fenti kritérium teljesítése esetében indokolt a fenntartó kezelés.
6. Fenntartó kezelés felnőttkori Crohn-betegségben (luminális)
6.1. Megfelelő válaszkészség (3 hónap alatt CDAI minimum 70 pontos csökkenése) esetén fenntartó kezelés folytatható önmagában vagy immunszuppresszív terápiával együtt. Extraintesztinális manifesztáció esetében a sikeresség elbírálásában a klinikai jelek javulása a mérvadó (EL3, RG C).
6.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban.
6.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
6.4. Vedolizumab esetén a kezelésre reagáló betegeknél a 14. héttől nyolchetente kell folytatni a terápiát.
6.5. Ustekinumab esetén: a hatékony indukciós terápiát követően az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt.
7. Különleges megfontolások a biológiai kezeléshez
7.1. Készítményválasztás
Luminalis Crohn-betegség esetén a két hasonló támadáspontú anti-TNF-a szer (infliximab, adalimumab) összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Hasonlóképpen nem rendelkezünk direkt összehasonlító adatokkal az anti-TNF-a és integrin-antagonista készítmények hatékonyságát tekintve. Az anti-TNF-α készítmények és immunszuppresszáns szerek (pl. azathioprin) kombinált alkalmazása előnyös lehet a hatékonyság szempontjából, de a kombinált immunszupresszió esetén gyakoribb mellékhatások (pl. fertőzések) megjelenésével kell számolnunk, így minden esetben a kockázat és az előny gondos mérlegelése mellett lehetséges. A vedolizumab esetében a – leginkább az egyidejű kortikoszteroiddal végzett – kombinációs kezelés hatékonyabbnak bizonyult a Crohn-betegség remissziójának indukciójában, mint az önmagában vagy immunmodulátorokkal egyidejűleg adott vedolizumab.
7.2. Dózismódosítás
7.2.1. Infliximab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente, vagy a kezelés 4 hetente is alkalmazható 5mg/ttkg dózisban. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile), abscessus, műtétet igénylő szűkület kizárása.
7.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.2.3. Vedolizumab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően a 8 hetente 300 mg-os adagokra kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén az infúziók közötti időintervallum négy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.2.4. Ustekinumab: a hatékony indukciós terápiát követően az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt. Azoknál, akiknél a 12 hetenkénti adagolás mellett megszűnik a válaszreakció, hasznos lehet az adagolási gyakoriság 8 hetenkéntire történő növelése. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.3. Készítményváltás: az első vonalban megkezdett anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. Az anti-TNF-α kezelés hatástalansága vagy hatásvesztés esetén alkalmazható másodvonalban az integrin antagonista vedolizumab vagy az interleukin inhibitor ustekinumab. A váltás előtt szükséges az aktivitás felmérése, szövődmények (elsősorban infekció, abscessus, műtétet igénylő szűkület) kizárása.
8. Szövődmények monitorozása, ellenőrzése
8.1. Opportunista infekciók
8.2. Malignus betegségek
8.3. Neurológiai eltérések
8.4. Secunder autoimmun betegségek
9. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
9.1. Evidencia szint (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c „Outcomes” research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
9.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
10. Luminalis Crohn-betegség kiterjedés és aktivitás szerint
10.1. Ileocoecalis Crohn-betegség
(5A) Enyhén aktív (CDAI: 151-220)
Enyhe tünetek, kezelés nem szükséges (EL5, RG D)
Mesalazin - értéke korlátozott (EL1a, RG B)
Budesonid 9 mg/nap (EL2a, RG B)
Antibiotikum nem ajánlott (EL1b, RG A)
(5B) Közepesen aktív (CDAI: 221-450)
Budesonid 9 mg/nap (EL1a, RG A)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Antibiotikum (septicus esetben) (EL5, RG D)
AZA/6-MP vagy MTX (EL1b, RG B)
Biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab); (CDAI>300 esetén finanszírozott) (EL1b, RG B): változatlan aktivitás esetén, vagy szteroid-refrakter, dependens, intoleráns esetben
(5C) Súlyosan aktív (CDAI: >450)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
Relapszus esetén biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab (EL1a, RG B csak infliximab): immunmodulátorral vagy nélküle
A sebészi megoldás alternatíva lehet (EL5 RG D)
10.2. Vastagbél Crohn-betegség
(5D) Enyhén aktív (CDAI: 151-220)
Sulfasalazin (EL1b, RG A)
Oralis szteroid (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
(5D) Közepes vagy súlyosan aktív (CDAI>220)
Relapszus esetén biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab (CDAI>300 esetén finanszírozott): immunmodulátorral vagy nélküle (EL1a, RG B csak infliximab)
A sebészi megoldás alternatíva lehet (EL5, RG D)
10.3. Kiterjedt vékonybél Crohn-betegség
(5E) Enyhén aktív (CDAI: 151-220)
Orális szteroid és AZA/6-MP vagy MTX (EL5, RG D)
(5E) Közepes vagy súlyosan aktív (CDAI>220)
Relapszus esetén biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab CDAI>300 esetén finanszírozott): immunmodulátorral, vagy nélküle (EL5, RG D)
Hyperalimentáció (EL4, RG C)
Sebészi megoldás alternatíva lehet
10.4. Várhatóan rossz prognózisú klinikai képpel járó eset
Korai AZA/6-MP/MTX, illetve anti-TNF-α terápia: [fiatalkori kezdet (<40 év) és perianalis CD] (EL5 RG D)
10.5. Nyelőcső, illetve gastroduodenalis Crohn-betegség
(5G) Enyhén aktív
PPI kezelés (EL5, RG D)
Oral szteroid + PPI (EL4, RG C)
Oral szteroid + PPI + AZA vagy MTX (EL4, RG D)
(5G) Közepes/súlyos aktivitásban/refrakter esetben
Anti-TNF-α (szteroid refrakter esetben finanszírozott) (EL4, RG D)
Obstructio esetén dilatáció/sebészi megoldás (EL4, RG C)
11. Aktivitási score-ok gyulladásos bélbetegségben
11.1. CDAI score (Best és mtsi, Gut, 1979).
|
|
|
|
|
|
|---|---|---|---|---|
|
1 |
Jellemző |
Pontszám |
Súlyszám |
Részösszeg |
|
2 |
folyékony vagy rendkívül híg székürítés száma a megelőző 7 napon |
x2 |
= |
|
|
3 |
A hasi fájdalom/görcsök intenzitása |
x5 |
= |
|
|
4 |
Általános közérzet |
x7 |
= |
|
|
5 |
Crohn-betegséggel összefüggő tünetek száma: |
x20 |
||
|
6 |
Hasmenés elleni gyógyszeres kezelés |
x30 |
||
|
7 |
Hasi terime |
x10 |
||
|
8 |
Hematokrit |
X6 |
||
|
9 |
Aktuális testsúly (ATS): |
x1 |
||
|
10 |
(Rendes testsúly - ATS)/ rendes testúly x 100%=pont |
|||
|
11 |
Összesen: |
12. Gyulladásos típusú Crohn-betegség klinikai súlyosságának meghatározása
12.1. Enyhe-középsúlyos betegség: járóbeteg, láztalan, hasi fájdalom nem jelentős, súlyvesztés nem haladja meg az eredeti testsúly 10%-át; nincsen hasi izomvédekezés, tapintható szövetmassza vagy kiszáradás jelei. (CDAI 150-220)
12.2. Középsúlyos-súlyos beteg: az a beteg, aki az enyhe-középsúlyos betegségre indikált gyógyszerekre nem reagál, lázas, testsúlyvesztése jelentős (>10%), hasi fájdalma van, sipolyképződéssel járó betegsége van, időszakosan hányinger vagy hányás gyötri (mely még nem utal bélelzáródásra), vérszegénysége jelentős. (CDAI: 220-450)
12.3. Súlyos-fulmináns betegség: szájon át alkalmazott szteroid, illetve immunszupprimáló kezelésre nem reagáló beteg, magas lázzal, gyakori hányással, bélelzáródásra utaló egyéb tünetekkel, hasi izomvédekezéssel, jelentős fogyással vagy hasi tályogra utaló klinikai jellel. (CDAI>450)
13. Az indikációk definiálása
13.1. Klasszikus terápia rezisztens Crohn-betegség (3 hónapon keresztül szteroid és optimalizált dózisú immunszuppresszánsra nem reagáló beteg).
13.2. Szteroid függő Crohn-betegség (a szakmai ajánlások szerinti fokozatos szteroid leépítés során egymást követő 2 alkalommal a betegség aktivitása ismét súlyossá válik).
13.3. Akut, terápia rezisztens Crohn-betegség [4 hét teljes dózisú szteroidra nem reagáló beteg, a betegség aktivitása mindvégig súlyos (CDAI>300), immunszuppresszáns terápia megkezdésére nincs idő, hiszen a készítmények 8-12 hét alatt érik el a terápiás hatást].
14. A Crohn-betegség betegnaplójának adatai
14.1. Általános adatok (név, TAJ, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
14.2. Laza, hasmenéses székletek számának 7 napra történő feltüntetése napi bontásban és összesítve,
14.3. A hasi fájdalom mértékének 7 napra történő feltüntetése napi bontásban és összesítve, (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
14.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
14.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
14.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
14.7. Aktuális testsúly (kg)
15. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
15.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
15.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
15.1.2. Betegadatok (online TAJ ellenőrzés)
15.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
15.2. Szakmai ellenőrzési pontok
Klinikai súlyosság meghatározása egy rögzítést megelőző héten vezetett betegnapló alapján számított Crohn-betegség aktivitási index (CDAI) (kivéve kizárólag felső gastrointestinalis érintettség és sztómával élő beteg esetén, utóbbi esetekben szteroid függőség vagy rezisztencia esetén a szteroid dózis legalább 50%-os csökkenése az ellenőrzés szempontja, de sztómával élő beteg esetén a székletszámot nem tartalmazó CDAI rögzítése is szükséges).
15.2.1. Inaktív betegség: CDAI≤150
15.2.2. Enyhe betegség: 150<CDAI≤220
15.2.3. Közepesen súlyos betegség: 220<CDAI≤300
15.2.4. Súlyos betegség: 300<CDAI≤450
15.2.5. Nagyon súlyos betegség: CDAI>450
15.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
15.3.1. TBC kizárása (mellkas RTG)
15.3.2. Egyéb akut és krónikus fertőzések kizárása (pl. hepatitis B és C)
15.3.3. Demyelinizációs betegség (vedolizumab és ustekinumab esetén nem jelent kontraindikációt), SLE kizárása (anamnesztikus adatok alapján)
15.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
15.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
15.3.6. Anti-TNF-α készítmények, vedolizumab és ustekinumab alkalmazási előírásában abszolút kontraindikációként szereplő súlyos, aktív fertőzés kizárása, illetve az anti-TNF-α készítmények esetén NYHA III/IV szívelégtelenség kizárása, mely a vedolizumab és az ustekinumab esetén nem jelent kontraindikációt.
15.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
15.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
15.4.2. 3 havonta: aktivitási index (CDAI meghatározása és dokumentálása)
15.4.3. szteroid refrakter esetben, kizárólag felső gastrointestinalis érintettség esetén a szteroid dózisának legalább 50%-os csökkentése az indukciós kezelés végéig
15.4.4. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
15.4.5. 9 hónap óta tartó fenntartó kezelés után, újabb 6 hónapnál hosszabb teljes remisszió (CDAI alacsonyabb, mint 150 pont három egymást követő meghatározás alkalmával) esetén a kezelés felfüggesztése mérlegelésének dokumentálása
15.4.6. 9 hónap óta tartó fenntartó kezelés után, a kezelés tartós folytatása esetén 12 havonta ellenőrző képalkotó vizsgálat (MR vagy endoszkópia, indokolt esetben CT) dokumentálása, valamint a kezelés kezdetén, majd szakmailag indokolt esetben hepatitis B és C szűrés, hepatitis B vakcináció esetén annak dokumentálása
15.4.7. A biológiai terápia megválasztása során a terápiás lépcsők betartásának és a terápia lefolytatásának ellenőrzése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
15.5. Megjegyzés
15.5.1. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
15.5.2. TNF-α gátlók: adalimumab, infliximab
15.5.3. integrin antagonista: vedolizumab
15.5.4. interleukin inhibitor: ustekinumab
16. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
16.1. A területre fordított közkiadások alakulása, monitorozása.
16.2. A helyes, finanszírozási algoritmus szerint kezelt betegek aránya.
17. A finanszírozás szempontjából lényeges finanszírozási kódok
17.1. A releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
Kód |
Elnevezés |
|
2 |
K5001 |
Terápiarezisztens vékonybél Crohn-betegség |
|
3 |
K5011 |
Terápiarezisztens vastagbél Crohn-betegség |
|
4 |
K5081 |
Terápiarezisztens vastag- és vékonybél Crohn-betegség |
|
5 |
K5012 |
Vastagbél Crohn-betegség fisztulával |
|
6 |
K5082 |
Vékony- és vastagbél Crohn-betegség fisztulával |
17.2. A releváns ATC kódok
|
|
A |
B |
C |
D |
|---|---|---|---|---|
|
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
|
3 |
A07EC02 |
mesalasin |
DMARD |
Betegségmódosító szerek |
|
4 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
|
5 |
L04AA33 |
vedolizumab |
BRMD |
Biológiai terápia eszközei |
|
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
|
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
|
8 |
L04AC05 |
ustekinumab |
BRMD |
Biológiai terápia eszközei |
|
9 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
|
10 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
11 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
12 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
|
13 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
18. Rövidítések:
ATC: |
Anatomical Therapeutic Chemical klasszifikáció |
|
BNO: |
Betegségek nemzetközi osztályozása” |
|
8. melléklet a 31/2010. (V. 13.) EüM rendelethez20
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Felnőttkori fisztulázó Crohn-betegség
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl. szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Perianalis fistulák kezelésében a szisztémás szteroid kezelés nem indokolt. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtét elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel bizonyosan nem tudjuk megváltoztatni. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a fisztulázó Crohn-betegség esetén a fistulák záródása, párhuzamos luminalis érintettség esetén a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroidmentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A felnőttkori fisztulázó Crohn-betegség aktivitása
A perianalis sipollyal járó betegségformák súlyosságának meghatározására a PDAI (Perianal disease Activity Index) alkalmas (EL5, RG D). PDAI 3 pontos csökkenésekor hatékonynak tartjuk a kezelést (klinikai választ). A remissziót a PDAI alapján a szakirodalom nem definiálja, azonban a sipolyváladékozás teljes megszűnése remissziónak tekinthető (EL2b, RG D). Crohn-betegséghez kapcsolt enterocutan vagy rectovaginalis sipolyok esetén részleges remissziónak tekinthető, ha a kezelés kezdetén aktív fisztulák váladékozása 3 hétnél hosszabb kezelést követően több mint 50%-kal csökken két egymást követő kontroll vizsgálat során. A sipolyváladékozás teljes megszűnése 2 egymást követő kontroll vizsgálat alkalmával remissziónak tekinthető.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
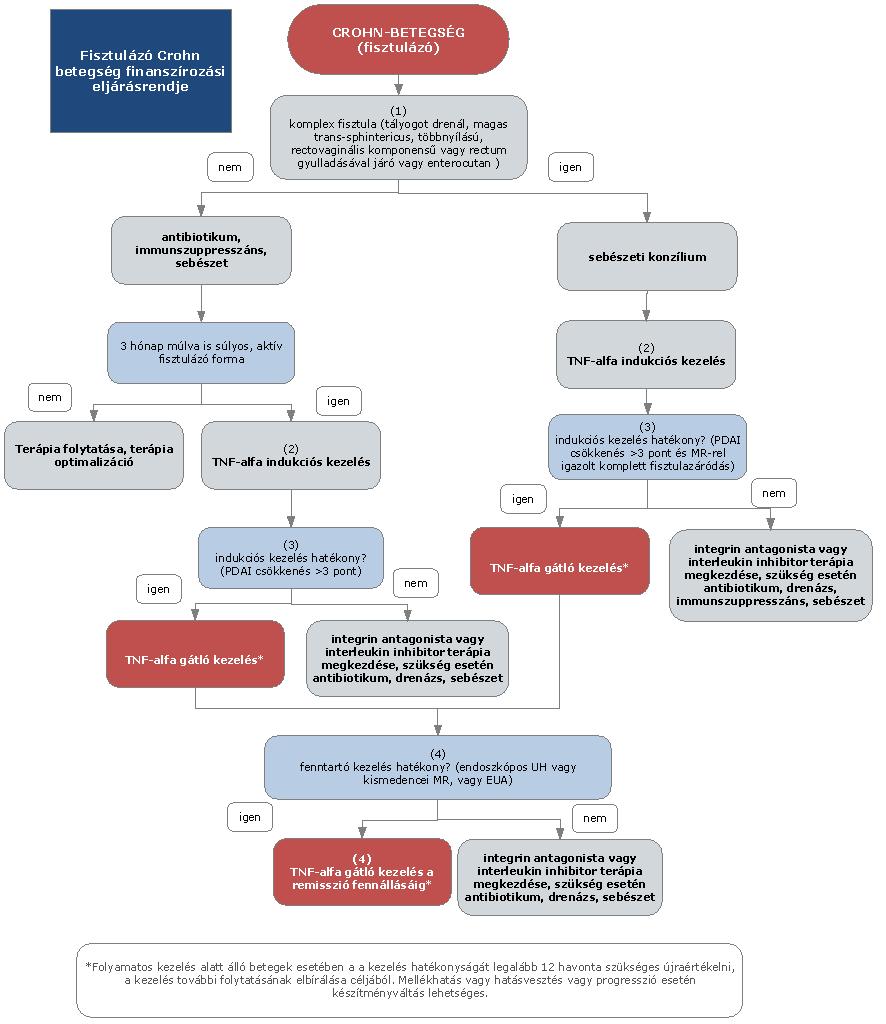
4. A felnőttkori fisztulázó Crohn-betegség biológiai kezelése
4.1. Indukciós kezelés sipolyozó Crohn-betegségben
Komplex perianális (több sipolynyílású, magas transphinctericus vagy tályoggal szövődött, gyulladt rectum nyálkahártya mellett kialakuló, vagy rectovaginalis helyzetű) vagy enterocutan fisztula esetén második vonalban [antibiotikum és azathioprin kezelés elégtelensége (PDAI>4) vagy intoleranciája esetén] indikált az anti-TNF-α kezelés (EL1a, RGB). Fisztulázó betegségtípusban az első vonalbeli kezelésnek nem része a szisztémás szteroidok alkalmazása. A tályogot drenáló fisztula anti-TNF-α kezelése csak a tályog drenálása (seton behelyezése) után kezdhető meg. Anti-TNF-α terápia hatástalansága vagy hatásvesztés esetén kezdhető meg az integrin antagonista vedolizumab vagy az interleukin inhibitor ustekinumab terápia.
4.2. A Magyarországon jelenleg engedélyezett készítmények közül:
4.2.1. Infliximab esetében: 5 mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. A 10-12. hétig nem reagáló betegek további infliximab kezelését nem támasztják alá a rendelkezésre álló adatok.
4.2.2. Az adalimumab törzskönyvi indikációja nem emeli ki a fisztulával járó Crohn-betegség kezelését, azonban nem is tiltja.
4.2.3. A vedolizumab törzskönyvi indikációja nem emeli ki a fisztulával járó Crohn-betegség kezelését, azonban nem is tiltja.
4.2.4. Az ustekinumab (UST) terápiát a testtömeg alapján számított egyszeri intravénás adaggal kell elkezdeni az alkalmazási előírásban foglaltak szerint. Az ustekimumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt.
4.3. A biológiai indukciós kezelés hatékonyságának ellenőrzése fisztulázó Crohn-betegségben
Fisztulázó kórforma esetében hatékony a kezelés, ha megfelelő fisztula-gyógyulás (PDAI csökkenés>3 pont, vagy ha a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése) igazolható.
5. Fenntartó kezelés fisztulázó Crohn-betegségben
5.1. Megfelelő válaszkészség (3 hónap alatt a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése vagy a PDAI>3 pontos csökkenése) esetén fenntartó kezelés folytatása javasolt önmagában vagy immunszuppresszív terápiával együtt.
5.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban.
5.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
5.4. Vedolizumab esetében: Hatékony indukciós kezelést követően 8 hetente alkalmazott 300 mg dózisban
5.5. Ustekinumab esetében: Hatékony indukciós terápiát követően az első 90 mg szubkután adag az intravénás dózis után, a 8. héten kell, hogy történjen. Ezt követően 12 hetenkénti adagolás javasolt.
6. Különleges megfontolások a biológiai kezeléshez
6.1. Készítményválasztás
Fisztulázó Crohn-betegség esetén a két anti-TNF-α szer (infliximab, adalimumab) összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Hasonlóképpen nem rendelkezünk direkt összehasonlító adatokkal az anti-TNF-α és integrin-antagonista készítmények hatékonyságát tekintve.
Sipolyozó betegségformában az infliximab EL1b, RGA erősségű, az adalimumab EL1b, RG B erősségű ajánlással alkalmazható. Az ustekinumab alkalmazható fistulázó Crohn-betegségben. A vedolizumab a luminaris aktivitás csökkentésére alkalmazható (EL 1b, RG B).
Kombinált immunszupresszió esetén gyakoribb infekciós mellékhatások megjelenésével kell számolnunk.
6.2. Dózismódosítás
6.2.1. Infliximab: Fisztula-képződéssel járó aktív Crohn-betegség esetén alkalmazott IFX kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente vagy 4 hetente 5 mg/ttkg alkalmazható. Ilyenkor fontos azonban a hatásvesztés okának tisztázása abscessus, műtétet igénylő szűkület kizárása.
6.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, abscessus, műtétet igénylő szűkület kizárása.
6.2.3. Vedolizumab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően a 8 hetente, 300 mg-os adagokra kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén az infúziók közötti időintervallum 4 hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
6.2.4. Ustekinumab: A hatékony indukciós terápiát követően az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt. Azoknál, akiknél a 12 hetenkénti adagolás mellett megszűnik a válaszreakció, hasznos lehet az adagolási gyakoriság 8 hetenkéntire történő növelése. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
6.3. Készítményváltás
A biológiai kezelés során a terápiás válasz elégtelensége vagy a válasz elvesztése után, másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. Az anti-TNF-α készítmények hatástalansága vagy hatásvesztés esetén kezdhető meg az integrin antagonista vedolizumab vagy az IL inhibitor ustekinumab terápia. A váltás hatástani csoporton belül vagy között bármely hatóanyag egyszeri alkalmazásával javasolt.
A váltás előtt szükséges az aktivitás felmérése, szövődmények (abscessus, műtétet igénylő szűkület) kizárása.
7. Szövődmények monitorozása, ellenőrzése
7.1. Opportunista infekciók
7.2. Malignus betegségek
7.3. Neurológiai eltérések
7.4. Secunder autoimmun betegségek
8. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
8.1. Evidencia szint (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c „Outcomes” research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
8.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
9. Fisztulázó Crohn-betegség kezelésének finanszírozott terápiás alkalmazásai
(9F) 1. perianalis tályog = sebészi megoldás (EL5, RG D)
9.1. Fisztula jellege szerint:
9.1.1. Egyszerű fisztula
9.1.2. Összetett fisztula rendszer
9.1.3. Kimenetel-fisztula
9.1.4. Rectovaginalis fisztula
9.2. Egyszerű fisztula
(9G) A fisztula csak panaszok esetén kezelendő
Panaszok esetén seton vagy fistulotomia (EL3, RG D)
Metronidazol és ciprofloxacin kezelés (EL3, RG D)
9.3. Összetett fisztularendszer
(9H) Összetett (komplex fisztula)
Sebészi seton ellátás javasolt (EL4, RG D)
Eltávolítása a kezelés sikerétől függ
(9I) Komplex kezelés
Az aktív luminalis Crohn-betegség kezelése szükséges a sebészi ellátás mellett (EL5, RG D)
(9J) Összetett (komplex fisztula)
Antibiotikum és AZA/6-MP az első terápia a sebészi ellátás mellett (EL4, RG D)
(9K) Második vonal
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Mindkét szer a második vonalban (EL1b, RG B)
anti-TNF-α terápia hatástalansága vagy hatásvesztés esetén:
• Vedolizumab a luminaris aktivitás csökkentésére alkalmazható (EL 1b, RG B)
• Ustekinumab
9.4. Kimenetel-fisztula
(9L) Terápiás hatékonyság és mérése
Váladékozás csökkenése (50%) (EL2b, RG D)
Kvantitatív - PDAI (EL5, RG D)
Váladékozás csökkenése (50%) és kismedence MRI vizsgálat (EL2b, RG D)
(9M) Terápia vezetése
AZA/6-MP (EL2b, RG C)
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Vedolizumab (EL 1b, RG B)
Ustekinumab
Seton drain (EL4 RG D)
Drainage és gyógyszeres kombináció (EL3 RG C)
Bármelyik fenntartó kezelés legalább 1 évig szükséges (EL1b, RG A)
(9N) Hatástalanság
Hatástalan biológiai terápia esetén tacrolimus vagy (EL1b, RG B) AZA/MTX és antibiotikum (EL5, RG D) visszaadása
Refrakter esetben diverzió (EL4, RG C)
Resectiós műtéti kezelés (pl. proctectomia) az utolsó lépés (EL5, RG D)
(9O) Ellátás speciális esetei
(9P) Rectovaginalis fisztula
Egyszerű anal-introital, tünet nélküli fisztula nem kíván kezelést (EL5, RG D)
Tünettel járó esetben sebészeti kezelés előtt, aktív Crohn-betegség (különösen a rectalis) fennállása esetén kezelendő (EL5, RG D)
Enterocutan fisztula
Részletes kivizsgálást követően, sebésszel történt konzultáció alapján, bélresectio mérlegelése mellett a komplex kezelés részeként, fentiek szerint kezelhető.
Interintesztinális fisztula
Kezelése elsősorban az érintett bélszakasz sebészi resectióján alapul, a gyógyszeres kezelés a sebészeti terápiával összhangban, annak előkészítéseként, kiegészítéseként alkalmazható.
9.5. Fisztula aktivitásának mérése szerint
9.5.1. Váladékozás mértéke alapján: fisztula hozamának csökkenése 50%-kal
9.5.2. Összetett pontszám alapján: PDAI
10. Aktivitási score perianalis fisztulázó Crohn-betegségben
10.1. Sipolyozó Crohn-betegség súlyosságának meghatározása (PDAI) (Irvine és mtsi, Journal of Clinical Gastroenterology, 1995)
|
|
|
|
|---|---|---|
|
1 |
Fisztula hozama |
|
|
2 |
nem váladékozik |
0 |
|
3 |
kis nyákos váladékozás |
1 |
|
4 |
közepes nyákos vagy gennyes váladékozás |
2 |
|
5 |
jelentős váladékozás |
3 |
|
6 |
fekulens váladékozás |
4 |
|
7 |
Fájdalom / aktivitás korlátozottsága |
|
|
8 |
tevékenységben nem korlátoz |
0 |
|
9 |
enyhe diszkomfort, korlátozottság nélkül |
1 |
|
10 |
közepes diszkomfort, bizonyos tevékenységek gátoltak |
2 |
|
11 |
jelentős diszkomfort, jelentős korlátozottság |
3 |
|
12 |
súlyos fájdalom és korlátozottság |
4 |
|
13 |
Szexuális aktivitás korlátozottsága |
|
|
14 |
nincs korlátozottság |
0 |
|
15 |
enyhe korlátozottság |
1 |
|
16 |
közepes korlátozottság |
2 |
|
17 |
jelentős korlátozottság |
3 |
|
18 |
szexuális funkciók gátoltak |
4 |
|
19 |
Perianalis betegség típusa |
|
|
20 |
nincs perianális megjelenés/skin tag |
0 |
|
21 |
fissura vagy „mucosal tear” |
1 |
|
22 |
kevesebb, mint 3 fisztula |
2 |
|
23 |
több mint 3 fisztula |
3 |
|
24 |
sphincterkárosodás vagy jelentős perianalis hámhiány |
4 |
|
25 |
Beszűrtség foka |
|
|
26 |
nincs beszűrtség |
0 |
|
27 |
minimális beszűrtség |
1 |
|
28 |
közepes beszűrtség |
2 |
|
29 |
jelentős beszűrtség |
3 |
|
30 |
tályog |
4 |
11. A Crohn-betegség betegnaplójának adatai
11.1. Általános adatok (név, TAJ, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
11.2. Laza, hasmenéses székletek számának 7 napra történő feltüntetése napi bontásban és összesítve,
11.3. A hasi fájdalom mértékének 7 napra történő feltüntetése napi bontásban és összesítve, (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
11.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
11.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
11.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
11.7. Aktuális testsúly (kg)
12. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
12.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
12.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
12.1.2. Betegadatok (online TAJ ellenőrzés)
12.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
12.2. Szakmai ellenőrzési pontok
12.2.1. A diagnózis kritériumainak rögzítése (BNO: K5012, K5082)
12.2.1.1. A fisztula típusának meghatározása a fizikális status, endoszkópos lelet és a kismedencei képalkotók (MR vagy rectalis UH) vagy EUA (anesztéziában végzett rectalis vizsgálat) alapján
12.2.1.2. Súlyosság meghatározása az alábbi kritériumok alapján (PDAI: perianalis betegség aktivitási index, 0-12)
12.2.1.3. Az indukciós kezelés hatásosságának rögzítése (PDAI csökkenés>3)
12.2.1.4. A 12.2.1.1. pontban felsorolt diagnosztikai módszerekkel igazolt remisszióig
12.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
12.2.2.1. TBC kizárása (mellkas RTG)
12.2.2.2. Egyéb akut és krónikus fertőzések kizárása (pl. hepatitis B és C szűrés)
12.2.2.3. Demyelinizációs betegség (vedolizumab és ustekinumab esetén nem jelent kontraindikációt) (SLE kizárása (anamnesztikus adatok alapján)
12.2.2.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
12.2.2.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
12.2.2.6. Labor: rutin
12.2.2.7. Anti-TNF-α készítmények, vedolizumab és ustekinumab alkalmazási előírásában abszolút kontraindikációként szereplő súlyos, aktív fertőzés kizárása, illetve az anti-TNF-α készítmények esetén NYHA III/IV szívelégtelenség kizárása, mely a vedolizumab és az ustekinumab esetén nem jelent kontraindikációt.
12.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
12.2.3.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
12.2.3.2. 3 havonta: aktivitási index (PDAI meghatározása és dokumentálása)
12.2.3.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
12.2.3.4. 9 hónap óta tartó fenntartó kezelés után, a kezelés tartós folytatása esetén ellenőrző képalkotó vizsgálat (MR vagy endoszkópia) mérlegelése, valamint a kezelés kezdetén, majd szakmailag indokolt esetben hepatitis B és C szűrés, hepatitis B vaccinatio esetén annak dokumentálása szükséges.
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
12.2.3.5. A biológiai terápia megválasztása során a terápiás lépcsők betartásának és a terápia lefolytatásának ellenőrzése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
Megjegyzés
12.2.3.6. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át.
12.2.3.7. TNF-α gátlók: adalimumab, infliximab, integrin antagonista: vedolizumab; IL inhibitor: ustekinumab.
12.2.3.8. Egy éven túli fenntartó kezelés feltétele az MR vagy rectalis UH vagy EUA vizsgálattal igazolt komplett fisztula-záródás.
13. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
13.1. A területre fordított közkiadások alakulása, monitorozása
13.2. A finanszírozási algoritmus szerint kezelt betegek aránya
14. A finanszírozás szempontjából lényeges finanszírozási kódok
14.1. A releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
Kód |
Elnevezés |
|
2 |
K5001 |
Terápiarezisztens vékonybél Crohn-betegség |
|
3 |
K5011 |
Terápiarezisztens vastagbél Crohn-betegség |
|
4 |
K5081 |
Terápiarezisztens vastag- és vékonybél Crohn-betegség |
|
5 |
K5012 |
Vastagbél Crohn-betegség fisztulával |
|
6 |
K5082 |
Vékony- és vastagbél Crohn-betegség fisztulával |
14.2. A releváns ATC kódok
|
|
A |
B |
C |
D |
|---|---|---|---|---|
|
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
|
3 |
A07EC02 |
mesalazin |
DMARD |
Betegségmódosító szerek |
|
4 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
|
5 |
L04AA33 |
vedolizumab |
BRMD |
Biológiai terápia eszközei |
|
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
|
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
|
8 |
L04AC05 |
ustekinumab |
BRMD |
Biológiai terápia eszközei |
|
9 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
|
10 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
11 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
12 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
|
13 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
15. Rövidítések:
ATC: |
Anatomical Therapeutic Chemical klasszifikáció |
|
BNO: |
Betegségek nemzetközi osztályozása” |
|
9. melléklet a 31/2010. (V. 13.) EüM rendelethez21
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Colitis ulcerosa
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa (CU) és a Crohn-betegség (CD) a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A colitis ulcerosa a vastagbél nyálkahártyájának fekélyes gyulladása, mely a rectumtól kezdve különböző hosszúságban érintheti a vastagbelet, ritkán a terminális ileumot („back wash ileitis”). A colitis ulcerosa természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll, az esetek egy részében az aktivitás folyamatos. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid, és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtéti kezelés elkerülése. Colitis ulcerosában gyakoriak a relapszusok, a betegség proximális irányban kiterjedtebbé válhat, az egész vastagbelet érintő esetek 10-20%-ában dysplasia, carcinoma alakul ki. A betegek 10-25%-a proctocolectomiára szorul. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma terápiás cél a klinikai, endoszkópos és szövettani remisszió (nyálkahártya-gyógyulás) elérése, a szteroidmentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. Colitis ulcerosa aktivitása
A colitis ulcerosa betegség aktivitását a jelenlegi eljárásrend endoszkópos lelet birtokában a Mayo-score meghatározásával, egyéb esetben a részleges Mayo-score alapján követi.
2.1.1. Mayo score alapján a colitis ulcerosa klinikai súlyosságának meghatározása
inaktív colitis ulcerosa: 0-3 pont között
enyhe colitis ulcerosa: 4-6 pont között
közepes colitis ulcerosa: 7-9 pont között
súlyos colitis ulcerosa: 9 pont felett
2.1.2. Mayo Score (Disease Activity Index) (Schroeder és mtsi., New England Journal of Medicine, 1987). A részleges Mayo-score az endoszkópos subscore-t nem tartalmazza.
|
|
|
|
|
|
|
|---|---|---|---|---|---|
|
1 |
0 |
1 |
2 |
3 |
|
|
2 |
Székletszám |
Normál |
1-2/nap >normál |
3-4/nap >normál |
5/nap >normál |
|
3 |
Rectalis vérzés |
Nincs |
Vércsíkok |
Egyértelmű |
Többségében vér |
|
4 |
Nyálkahártya |
Normál |
Enyhén sérülékeny |
Közepesen sérülékeny |
Spontán vérzések |
|
5 |
Orvos általános megítélése |
Normál |
Enyhe |
Közepes |
Súlyos |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
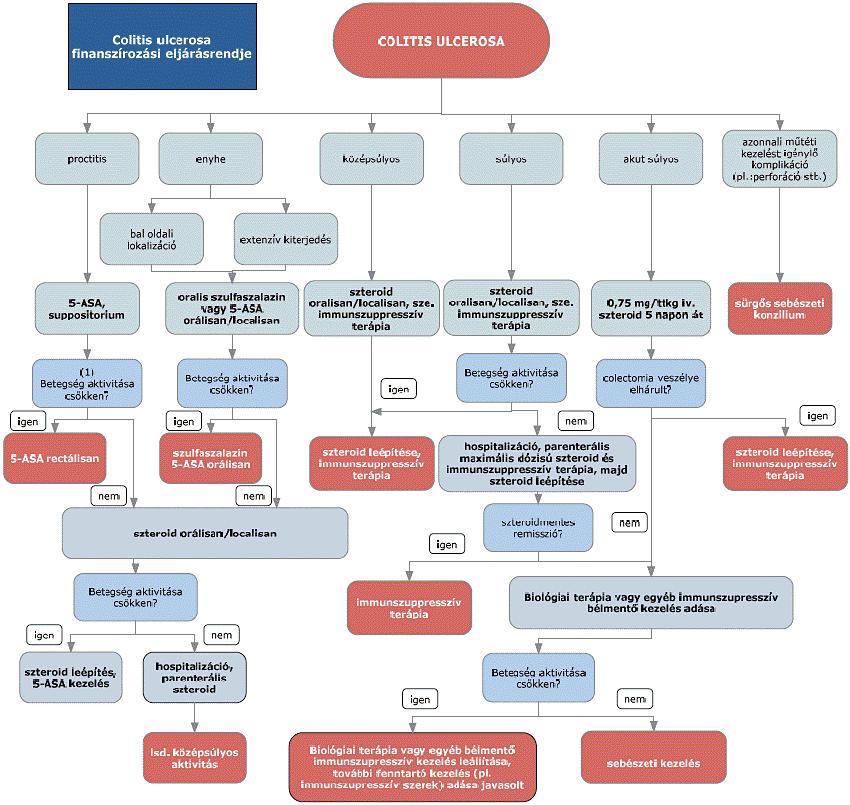
4. A Colitis ulcerosa betegnaplójának adatai
4.1. Általános adatok (név, TAJ, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
4.2. Székletek számának 7 napra történő feltüntetése napi bontásban és átlagolva,
4.3. Véres széklet számának 7 napra történő feltüntetése napi bontásban és átlagolva.
5. Szteroid kezelés fő problémái
5.1. Szteroid refrakter gyulladásos bélbetegség (IBD): akut, súlyos colitis ulcerosa esetében teljes dózisú parenterális szteroid kezelés ellenére 5 nap után is aktív a betegség.
5.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
6. Colitis ulcerosa biológiai kezelése
6.1. Indukciós kezelés súlyos, aktív colitis ulcerosában: a hagyományos terápiára nem reagáló, illetve a felnőttkori, súlyos (18 éves kor felett, Mayo score ≥ 9) colitis ulcerosa kezelésére vonatkozik.
6.1.1. Hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy intoleráns, immunszuppresszív szer mellett szteroid dependens, vagy immunszuppresszív szerre intoleráns, közepesen súlyos, krónikusan aktív colitis ulcerosában 5 mg/ttkg infliximab kezelés (a 0., 2. és 6. héten) vagy szubkután adalimumab terápia (0. héten 160 mg, 2. héten 80 mg, majd 2 hetente 40 mg sc. 3 hónapig).
6.1.2. Súlyos, fulmináns, 5 napos intravénás szteroid kezelésre nem reagáló colitis ulcerosában, amennyiben colectomia szükségessége fenyeget, a műtéti kezelés előtt egy alkalommal megkísérelhető az 5 mg/ttkg dózisú IFX kezelés. Hatékonyság esetén a teljes indukciós kezelést (5 mg/ttkg IFX parenterálisan a 2. héten és 6. héten) alkalmazni kell. Adalimumab, ustekinumab és vedolizumab ebben a betegcsoportban nem alkalmazható. Tofacitinib esetén a rutinszerű alkalmazás nem javasolt.
6.1.3. Vedolizumab indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-α szerre nem reagáló közepesen súlyos, krónikusan aktív colitis ulcerosában (testtömegtől függő intravénás dózist követően a 8. héten 1 adag subcutan injekció).
6.1.4. Usztekinumab indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-α szerre nem reagáló közepesen súlyos, krónikusan aktív colitis ulcerosában (16. hétre klinikai remisszió).
6.1.5. Tofacitinib indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-α szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában. (Az ajánlott bevezető dózis 8 hétig naponta kétszer 10 mg szájon át adva. Azoknál a betegeknél, akiknél a 8. hétre nem alakul ki megfelelő terápiás előny, a naponta kétszer 10 mg-os bevezető adag alkalmazása további 8 hétre kiterjeszthető (ez összesen 16 hetet jelent), amelyet naponta kétszer 5 mg fenntartó adag követ. A tofacitinib bevezető kezelést abba kell hagyni azoknál a betegeknél, akiknél a 16. hétig nem alakulnak ki a terápiás előnyre utaló bizonyítékok.)
6.2. A biológiai indukciós kezelés hatékonyságának ellenőrzése colitis ulcerosában
A komplett indukciós kezelés hatékonyságának felmérésére a részleges Mayo-score javasolt.
6.2.1. Szteroid dependens colitis ulcerosa esetén alkalmazott infliximab, adalimumab, vedolizumab, usztekinumab vagy tofacitinib kezelés hatékonynak tekinthető, ha változatlanul kielégítő klinikai státusz mellett a szteroid kezelés legalább 3 hónapon át elhagyhatóvá vált. Törekedni kell a nyálkahártya gyógyulás elérésére.
6.2.2. Szteroid rezisztens (nem fulmináns) colitis ulcerosa esetében a hatékonyság felmérésére a 12. héten alkalmazott, Mayo-subscore (endoszkópos vizsgálat nélkül) legalább 3 pontos csökkenése javasolt.
7. Fenntartó kezelés colitis ulcerosában
7.1. Az infliximabbal történt indukciós kezelés által elért remissziót követően indokolt infliximab fenntartó terápia alkalmazása a 14. héttől 5 mg/ttkg dózisban 8 hetente. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok szerint pontosan nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.2. Az adalimumabbal történt indukciós kezelés által elért remissziót követően indokolt adalimumab fenntartó terápia alkalmazása a 12. héttől szubkután 40 mg dózisban 2 hetente. A fenntartó kezelés hossza nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.3. A vedolizumabbal történt indukciós kezelés által elért remissziót követően indokolt vedolizumab fenntartó terápia alkalmazása a 14. héttől 300 mg dózisban 8 hetente. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok alapján pontosan nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben, ismételt terápiás lehetőségként alkalmazható.
7.4. Az usztekinumabbal történt indukciós kezelés által elért adekvát klinkiai választ követően indokolt usztekinumab fenntartó terápia, alkalmazása 8 hetenként vagy 12 hetenként történhet. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok alapján pontosan nem meghatározott. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) remisszió esetén a kezelés felfüggeszthető. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben, ismételt terápiás lehetőségként alkalmazható.
7.5. A tofacitinibbel történt indukciós kezelés által elért remissziót követően indokolt tofactinib fenntartó terápia alkalmazása a 16. héttől. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok alapján pontosan nem meghatározott. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) remisszió esetén a kezelés felfüggeszthető. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben, ismételt terápiás lehetőségként alkalmazható.
7.6. Amennyiben a relapszus a kezelés felfüggesztése után 6 hónapon belül lép fel, reindukciós kezelés sem infliximab, sem adalimumab, sem vedolizumab, sem usztekinumab, sem tofacitinib esetén nem indokolt, a fenntartó kezelés folytatása javasolt, de a biológiai terápia újraindítása előtt a relapszus klinikai képét utánzó esetleges egyéb okok kizárása (pl. infekció, szövődmények stb.) szükséges.
8. Különleges megfontolások a biológiai kezeléshez
8.1. A készítményválasztás kérdése:
Az infliximab bizonyítottan hatásos terápia refrakter indeterminált colitis és pouchitis eseteiben is.
Az anti-TNF-α készítmények és más immunszuppresszáns szerek (pl. azathioprin vagy szteroid) kombinált alkalmazása a mellékhatások gyakoribb előfordulása miatt (pl. fertőzéses szövődmények) a kockázat és előny mérlegelése után lehetséges.
Az anti-TNF-α szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában kezdhető meg a vedolizumab vagy tofacitinib kezelés.
8.2. Dózismódosítás
Az aktív colitis ulcerosa esetén alkalmazott infliximab kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban. Rendelkezésre állnak irodalmi adatok a 10 mg/ttkg és a 4 hetente 5 mg/ttkg dózis hatékonyságáról is.
Az aktív colitis ulcerosa esetén alkalmazott adalimumab kezelés esetében hatékony indukciós kezelést követően 2 hetente 40 mg dózisban. Adalimumab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé, de azon betegeknél, akiknél csökken a terápiás hatás, lehetőséget ad a 40 mg-os dózis hetenként történő alkalmazására. Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Vedolizumab: Közepesen súlyos-súlyos, aktív colitis ulcerosa esetében hatékony indukciós kezelést követően a 8 hetente, 300 mg-os adagokra kezdetben reagáló, remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén az infúziók közötti időintervallum négy hétre csökkenthető. Ilyenkor – amennyiben lehetséges – a hatásvesztés okának tisztázása javasolt.
Usztekinumab: A kezelés abbahagyása mérlegelendő azoknál a betegeknél, akik 16 héttel az intravénás és subcutan indukciós dózis után, vagy a 8 hetenkénti fenntartó adagolásra történő átállítás után 16 héttel nem mutatnak a kedvező terápiás hatásra utaló bizonyítékot. A kezelés alatt az immunmodulátorok és/vagy kortikoszteroidok adása folytatható.
Tofacitinib: A fenntartó kezeléshez nem ajánlott a napi kétszeri 10 mg tofacitinib alkalmazása azoknál a colitis ulcerosában szenvedő betegeknél, akiknél ismerten fennállnak a vénás thromboembolia (VTE) kockázati tényezői, kivéve akkor, ha nem áll rendelkezésre megfelelő alternatív kezelési mód. Azoknál a colitis ulcerosában szenvedő betegeknél, akiknél nem áll fenn a VTE kialakulásának fokozott kockázata, meg lehet fontolni a napi kétszer 10 mg-os tofacitinib-dózis alkalmazását abban az esetben, ha a beteg terápiás válasz gyengülését tapasztalja a napi kétszer 5 mg tofacitinib alkalmazásakor, és nem reagál a colitis ulcerosa kezeléséhez rendelkezésre álló alternatív lehetőségekre, pl. a tumornekrózisfaktor-gátló (TNF-inhibitor) kezelésre. A napi kétszer 10 mg-os tofacitinib-dózist fenntartó kezelésként csak a lehető legrövidebb ideig szabad alkalmazni. A terápiás válasz fenntartásához szükséges legkisebb hatásos dózist kell alkalmazni.
8.3. Készítményváltás
A biológiai kezelés során a terápiás válasz elégtelensége vagy a válasz elvesztése után másik szerre való váltás megengedett. Jelenleg két anti-TNF-α és egy integrin-antagonista készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás hatástani csoporton belül vagy azok között, bármely hatóanyag egyszeri alkalmazásával javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (pl. fertőzések) kizárása.
Az anti-TNF-α szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában kezdhető meg a vedolizumab vagy a tofacitinib kezelés.
9. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható készítmények
Salazopyrin intolerancia, illetve jelentős szisztémás szteroid mellékhatás esetén az életkorra vonatkozó indikációs megkötések és az adott készítmény alkalmazási előírásában szereplő javallatok figyelembevételével: budesonid, mesalazin hatóanyagú készímények (Eü90, 11/b).
10. Szövődmények monitorozása, ellenőrzése
10.1. Opportunista infekciók
10.2. Malignus betegségek
10.3. Neurológiai eltérések
10.4. Indukált autoimmun kórképek
11. A felnőttkori colitis ulcerosa finanszírozásának ellenőrzési kritériumai
11.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
11.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
11.1.2. Betegadatok (online TAJ ellenőrzés)
11.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
11.2. Szakmai ellenőrzési pontok
A diagnózis kritériumainak rögzítése (BNO: K5180, K5190) klinikai tünetek és endoszkópos lelet alapján. A betegség klinikai tüneteinek és aktivitásának meghatározása (a vizitet megelőző egy héten át vezetett betegnapló alapján) és dokumentálásának ellenőrzése (Mayo score).
11.2.1. Klinikai tünetek Mayo kritériumok alapján: Mayo score maximum 12 pont
11.2.2. Enyhe colitis ulcerosa (Mayo score ≤6)
11.2.3. Közepesen súlyos colitis ulcerosa (6< Mayo score ≤9)
11.2.4. Súlyos colitis ulcerosa (Mayo score >9)
11.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
11.3.1. TBC kizárása (mellkas RTG)
11.3.2. Egyéb akut és krónikus fertőzések kizárása (pl. hepatitis B és C szűrés)
11.3.3. Demyelinizációs betegség (vedolizumab esetén nem jelent kontraindikációt), SLE kizárása (anamnesztikus adatok alapján)
11.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
11.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
11.3.6. Labor: rutin
11.3.7. Anti-TNF-α készítmények és vedolizumab alkalmazási előírásában abszolút kontraindikációként szereplő súlyos, aktív fertőzés kizárása, illetve az anti-TNF-α készítmények esetén NYHA III/IV szívelégtelenség kizárása, mely a vedolizumab esetén nem jelent kontraindikációt.
11.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
11.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
11.4.2. 3 havonta: aktivitási index (endoscopia nélküli Mayo subscore meghatározása és dokumentálása)
11.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
11.4.4. A kezelés kezdetén, majd szakmailag indokolt esetben hepatitis B és C szűrés, hepatitis B vaccinatio esetén annak dokumentálása szükséges.
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
11.5. Megjegyzés
11.5.1. Súlyos: Mayo score 9
11.5.2. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
11.5.3. Fenyegető colectomia esetén sebészeti konzílium szükséges akut súlyos, iv. szteroid-refrakter esetben
11.5.4. Legalább 2 mg/ttkg dózisú, vagy a legnagyobb tolerálható dózisú AZA mellett szisztémás szteroid igény 3 hónapon át (10 mg prednisolon ekvivalens szteroid dózis alatt Mayo≥9 és Mayo≥2 endoszkópos subscore)
11.5.5. Mayo score csökkenése minimum 3 ponttal
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
12. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
12.1. A területre fordított közkiadások alakulása, monitorozása.
12.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
13. A finanszírozás szempontjából lényeges finanszírozási kódok
13.1. A releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
Kód |
Elnevezés |
|
2 |
K5180 |
Colitis ulcerosa egyéb |
|
3 |
K5190 |
Colitis ulcerosa k.m.n. |
13.2. A releváns ATC kódok
|
|
A |
B |
C |
D |
|---|---|---|---|---|
|
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
2 |
A07EC01 |
szulfasalazin |
DMARD |
Betegségmódosító szerek |
|
3 |
A07EC02 |
mesalazin |
DMARD |
Betegségmódosító szerek |
|
4 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
|
5 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
|
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
|
7 |
L04AA33 |
vedolizumab |
BRMD |
Biológiai terápia eszközei |
|
8 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
|
9 |
L04AC05 |
usztekinumab |
BRMD |
Biológiai terápia eszközei |
|
10 |
L04AA29 |
tofacitinib |
BRMD |
Biológiai terápia eszközei |
|
11 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
|
12 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
13 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
14 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
|
15 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
14. Rövidítések:
ATC: |
Anatomical Therapeutic Chemical klasszifikáció |
|
BNO: |
Betegségek nemzetközi osztályozása” |
|
10. melléklet a 31/2010. (V. 13.) EüM rendelethez22
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Plakkos psoriasis
2. A kórkép leírása
A psoriasis krónikus gyulladásos bőrbetegség, mely többnyire jól körülírt területen erythemas papulosus, plakkos elváltozással jár. Számos betegnél ízületi érintettség is diagnosztizálható. A betegség jellemzője, hogy a betegek jelentős része állandó kiterjedt bőrtünetektől szenved. Hasonlóan az AP-hoz, a betegek funkcionális képessége, életminősége, általános egészségi állapota rendkívül kedvezőtlen. Az európai országokban a megbetegedés az össznépesség mintegy 1,4-2%-át érinti.
2.1. Autoimmun gyulladásos bőrgyógyászati betegségek: psoriasis
A psoriasis kezelését alapvetően a bőrtünetek kiterjedtsége, lokalizációja és jellege, illetve az egyéb kísérő tünetek (arthritis) jelenléte határozza meg. A kezelést elsősorban a rendelkezésre álló lokális, szisztémás és fototerápia jelenti. A kis kiterjedésű betegség esetén (a testfelület kevesebb, mint 10%-a) a lokális kezelés preferálható. A nagyobb kiterjedésű psoriasisban (BSAI≥10, a testfelület több mint 10%-a) a fototerápia és a szisztémás kezelés (metotrexát, cyclosporin, retinoidok) alkalmazása kerül előtérbe. A súlyos szisztémás kezelésre nem reagáló, továbbra is aktív kórfolyamatokban, illetve azokban az esetekben, amikor intolerancia, illetve a beteg egészségi állapotát veszélyeztető súlyos mellékhatás miatt a standard szisztémás kezelés kontraindikált, biológiai terápia alkalmazása indokolt. A biológiai terápia standard kezeléssel szembeni hosszú távú veszélyei és előnyei jelenleg csak részben ismertek.
2.2. A plakkos psoriasis aktivitása
A biológiai terápia indikációjának felállításakor a betegség súlyosságát és az életminőségre gyakorolt hatását definiálni kell. A krónikus súlyos plakkos psoriasisban a szakmai irányelv a „psoriasis kiterjedési és súlyossági indexet” (PASI, értéke 0-72 között) javasolja a betegség súlyosságának megítélésére. Amennyiben a PASI nem meghatározható (pl. erythrodermiás vagy pustulosus psoriasis), az érintett „testfelszín százalékban kifejezett értéke” (BSA) a mérvadó. A 10% feletti érték súlyos betegségként definiálható. A „Bőrgyógyászati Életminőségi Index” (DLQI, értéke 0-30 között) a bőrbetegségek által okozott életminőségbeli eltérések mérésére alkalmas mérőszám, ahol a 10 feletti érték már igen kifejezett életminőségbeli romlást jelez.
2.3. A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése
2.3.1. Klinikai tünetek súlyossága
2.3.2. PASI „psoriasis kiterjedési és súlyossági index” (értéke 0-72 között)
2.3.3. BSA „testfelszín százalékban kifejezett értéke” (súlyos 10% felett)
2.3.4. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
2.3.5. Ízületi érintettség esetén: DAS 28, BASDAI index meghatározása
2.4. A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005, L4090)
2.4.1. PASI, BSA, DLQI dokumentálása
2.4.2. Reumatológus konzílium dokumentálása ízületi érintettség esetén
2.4.3. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása
2.4.4. Axiális ízületi érintettség esetén: BASDAI index dokumentálása
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
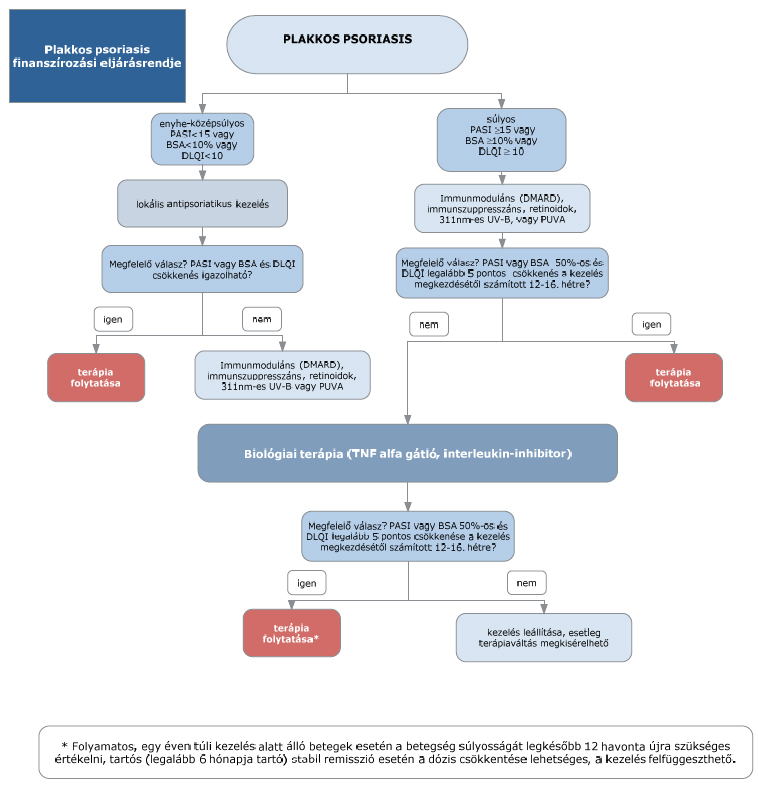
4. A plakkos psoriasis kezelése
Standard szisztémás kezelési módszerek alatt a következőket értjük: acitretin, ciclosporin, metotrexát, szűk spektrumú ultraibolya (UV) B, és psoralen + UVA fotokemoterápia. Standard kezelési módszerekre nem reagáló eset: nem kielégítő klinikai javulás (kevesebb mint 50%-os PASI vagy BSA javulás a kiindulási értékhez képest, és a DLQI kevesebb mint 5 pontos javulása) a következő kezelési módszerekkel végzett legalább 3 hónapig tartó terápiás dózisú kezelés után: cyclosporin 2,5-5,0 mg/tskg/nap, vagy metotrexát egyszer 15 mg/hét (max. 25-30 mg), vagy acitretin 25-50 mg/nap, vagy szűkspektrumú UVB vagy PUVA (klinikai javulás hiánya, gyors recidíva vagy a maximálisan ajánlott dózisok elérése - PUVA: 150-200 kezelés, UVB: 350 kezelés).
4.1. Biológiai terápia: indukciós kezelés súlyos, aktív plakkos psoriasisban
4.1.1. A kezelés előtt rögzíteni kell:
4.1.1.1. PASI „psoriasis kiterjedési és súlyossági indexet” (értéke 0-72 között)
4.1.1.2. BSA „testfelszín százalékban kifejezett értéke” erythrodermiás vagy pustulosus psoriasis esetén
4.1.1.3. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
4.2. TNF-alfa vagy interleukin-inhibitor gátló terápia felnőttkori súlyos plakkos psoriasisban javasolt, amennyiben az alábbi kritériumok együttesen teljesülnek:
4.2.1. súlyos psoriasis fennállása esetén, amennyiben a teljes PASI nagyobb, mint 15 és a DLQI nagyobb, mint 10, és
4.2.2. legalább 3 hónapig tartó, standard szisztémás kezelés (metotrexát, cyclosporin, retinoid és PUVA) ellenére a betegség továbbra is súlyos, azaz PASI nagyobb, mint 15 és a DLQI nagyobb, mint 10, vagy a szisztémás kezeléssel szemben dokumentált intolerancia vagy kontraindikáció áll fenn.
4.3. Az anti-TNF-alfa és az interleukin-inhibitor indukciós kezelés hatékonyságának ellenőrzése plakkos psoriasis kezelésében
A kezelés 12-16. hetében meg kell határozni a PASI index összetevőit. Amennyiben a 12-16. hétre nem következik be PASI érték 50%-os javulása, illetve a DLQI 5 pontos, vagy annál nagyobb mérvű csökkenése, vagy súlyos mellékhatások lépnek fel, az elsőként választott biológiai kezelést le kell állítani. Bármely biológiai készítménnyel történő kezelés leállítása esetén másik biológiai válaszmódosító szer alkalmazása megkísérelhető, amennyiben egyéb kontraindikáció nem áll fenn.
4.4. Fenntartó kezelés plakkos psoriasis biológiai kezelésében
A kezelés további folytatásának eldöntése céljából háromhavonta rögzíteni kell:
4.4.1. PASI „psoriasis kiterjedési és súlyossági index” (értéke 0-72 között)
4.4.2. BSA „testfelszín százalékban kifejezett értéke” erythrodermiás vagy pustulosus psoriasis esetén
4.4.3. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
4.4.4. Folyamatos egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.5. Az anti-TNF-alfa és az interleukin-inhibitor kezelés további folytatásának kritériumai
4.5.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α vagy IL inhibitor terápiára történő váltás (switch) megengedett.
4.5.2. Az anti-TNF-α terápia nem folytatható, amennyiben anti-TNF-α terápia ellenére 6 hónap alatt megfelelő terápiás válasz nem volt elérhető: primer hatástalanság.
4.5.3. Anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett: szekunder hatástalanság.
4.5.4. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben induló dózishoz képest nem javasolt.
4.5.5. A kijelölt intézmények szakavatott és a biológiai terápia alkalmazásában jártas bőrgyógyász szakorvosainak a kompetenciája az anti-TNF-α és IL-inibitor terápia indikálása és alkalmazása.
4.5.6. Az interleukin-inhibitor terápia társadalombiztosítási támogatással történő alkalmazása az anti-TNF-α terápia alkalmazásának feltételeivel azonos.
4.6. Biológiai terápiát megelőzően elvégzendő vizsgálatok
4.6.1. Teljes vérkép
4.6.2. Vizelet
4.6.3. Elektrolitok
4.6.4. Májfunkciós értékek
4.6.5. Vesefunkció
4.6.6. Antinukleáris antitestek
4.6.7. Anti-DNS
4.6.8. VVT-süllyedés, CRP
4.6.9. Hepatitis B és C vírus szerológia (esetleg hepatitis E)
4.6.10. HIV teszt
4.6.11. Terhességi teszt nőknél
4.6.12. Kétirányú mellkasröntgen, vagy Mantoux próba (kérdéses esetben pulmonológus konzílium)
4.6.13. Testsúly/testmagasság
5. Szövődmények monitorozása, ellenőrzése TNF-alfa gátló és interleukin-inhibitor kezelés alkalmazása esetén
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel, az egyéni rizikófaktorok felmérésével és figyelembevételével.
5.1.2. Különös gondot kell fordítani a
5.1.2.1. tuberculosis kizárására (mellkas röntgen),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a látens TBC veszélye, gátlószeres kezelés mellett adható a biológiai kezelés.
5.1.3. A kezelés időtartama alatt félévente-évente mellkas röntgen szükséges.
5.1.4. A biológiai terápia kezdetekor a latens és aktiv tuberculosis felismeréséhez szükséges vizsgálatokról, illetve a biológiai kezelés során a tuberculosis monitorizálásáról a szakmai irányelvek rendelkeznek.
5.1.5. Krónikus vírushepatitis sem jelent abszolút kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.2. Malignus betegségek
5.2.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.2.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.3. Neurológiai eltérések
5.3.1. Nervus opticus neuritis
5.3.2. Demyelinizációs kórképek
5.4. Egyéb mellékhatások
5.4.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.4.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
6. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. Kompetencia szint: kijelölt intézmény, eszközellátottság (UV), szakorvosi kompetencia
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005)
6.2.1.1. A betegség aktivitásának és súlyosságának dokumentálása
6.2.1.2. Klinikai tünetek súlyossága
6.2.1.3. PASI „psoriasis kiterjedési és súlyossági index” (értéke 0-72 között)
6.2.1.4. BSA „testfelszín százalékban kifejezett értéke” (súlyos 10% felett)
6.2.1.5. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
6.2.1.6. Reumatológus konzílium dokumentálása (ízületi érintettség esetén)
6.2.1.7. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása
6.2.1.8. Axiális ízületi érintettség esetén: BASDAI index dokumentálása
6.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
6.2.2.1. TBC kizárása (mellkas RTG, esetleg Mantoux próba)
6.2.2.2. Fertőzések kizárása
6.2.2.3. Demyelinizációs betegség kizárása, autoimmun betegség (pl. SLE) kizárása
6.2.2.4. Terhesség kizárása
6.2.2.5. Szociális körülmény alkalmatlansága
6.2.2.6. Labor [rutin, immun (ANA, ANF)]
6.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
6.2.3.1. Indukciós kezelés alatt havonta: labor (We, FVS, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, vizelet)
6.2.3.2. Fenntartó kezelés alatt 1-3 havonta klinikai szituációtól függően: labor (We, FVS, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, vizelet)
6.2.3.3. Az indukciós kezelés hatásának felmérésére a kezelés 12-16. hetében, majd 3 havonta: aktivitási index (PASI, BSA, DLQI)
6.2.3.4. 6-12 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
6.2.3.5. Tartósan 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e
6.3. Megjegyzés
6.3.1. Standard szisztémás terápiák: immunmoduláns, immunszuppresszáns kezelések: metotrexát, cyclosporin A, terápiás dózisban
6.3.2. Retinoidok: acitretin
6.3.3. TNF-alfa gátlók: adalimumab, etanercept, infliximab, certolizumab-pegol (az alkalmazott támogatási kategória figyelembevételével)
6.3.4. Interleukin-inhibitor: usztekinumab, ixekizumab, szekukinumab, guszelkumab, rizankizumab
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A területre fordított közkiadások alakulása.
7.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. Releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
BNO |
BNO megnevezése |
|
2 |
L4050 |
Arthropathiás psoriasis (M07.0-M07.3*, M09.0*) |
|
3 |
L4003 |
Psoriasis vulgaris, kp.súlyos (PASI-SCORE 11-18) |
|
4 |
L4004 |
Psoriasis vulgaris, súlyos (PASI-SCORE 19-30) |
|
5 |
L4005 |
Psoriasis vulgaris, nagyon súlyos (PASI-SCORE 31-44) |
|
6 |
L4090 |
Psoriasis k.m.n. |
8.2. Releváns ATC kódok
|
|
A |
B |
C |
D |
|
1 |
ATC-kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
2 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
|
3 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
|
4 |
D05BB02 |
acitretin |
Retinoid |
Antipsoriatikus szisztémás szer |
|
5 |
L04AB01 |
etanercept |
BRMD |
Biológiai terápia eszközei |
|
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
|
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
|
8 |
L04AC05 |
usztekinumab |
BRMD |
Biológiai terápia eszközei |
|
9 |
L04AC10 |
szekukinumab |
BRMD |
Biológiai terápia eszközei |
|
10 |
L04AC13 |
ixekizumab |
BRMD |
Biológiai terápia eszközei |
|
11 |
L04AC16 |
guszelkumab |
BRMD |
Biológiai terápia eszközei |
|
12 |
L04AB05 |
certolizumab-pegol |
BRMD |
Biológiai terápia eszközei |
|
13 |
L04AC18 |
rizankizumab |
BRMD |
Biológiai terápia eszközei |
9. Fogalmak, rövidítések
ALAT Alanin-aminotranszferáz
ASAT Aszpartát-aminotranszferáz
ATC Anatomical Therapeutic Chemical klasszifikáció
BASDAI Bath Ankylosing Spondylitis Disease Activity Index
BNO Betegségek nemzetközi osztályozása
BSA Body surface area
CRP C-reaktív protein
DAS28 Disease Activity Score
DMARD Disease-modifying antirheumatic drugs
DLQI Dermatology Life Quality Index
FVS Fehérvérsejtszám szám
GGT Gamma-glutamil-transzferáz
K Kálium
Karb Karbamid-nitrogén
Kreat Kreatinin
Na Nátrium
PASI Psoriasis kiterjedési és súlyossági index
PUVA Psoralen + ultraviola sugárzás A
RTG Röntgen
SLE Szisztémás lupus erythematosus
TBC Tüdőtuberkolózis
TNF Tumor necrosis factor
tskg Testsúly kilogramm
UVA Ultraviola sugárzás A
UVB Ultraviola sugárzás B
We Vörösvértest-süllyedés
11. melléklet a 31/2010. (V. 13.) EüM rendelethez23
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Rheumatoid arthritis (C00-C97)
2. A kórkép leírása
A rheumatoid arthritis (RA) krónikus, progresszív sokízületi gyulladással járó betegség. A betegség feltételezhetően autoimmun eredetű. A rheumatoid arthritis sújtotta betegek jelentős része állandó gyulladásos fájdalomtól szenved. A hagyományos betegségmódosító gyógyszerek a betegek jelentős részénél, főleg a hevesebb, súlyosabb eseteknél hatástalanok (non-responder, refrakter esetek). A magasabb gyulladásos aktivitás, a koraibb ízületi károsodás és a funkcionális kiesés, valamint az életminőség csökkenése szorosan összefüggenek. A rheumatoid arthritist nagyfokú gyulladás, következményes ízületi destrukció jellemzi. Kulcs-citokinjei a tumor-nekrózis faktor-alfa (TNF), interleukin-1, interleukin-6 és a RANK-ligand (RANKL). A biológiai terápia irányulhat a TNF gátlására, valamint célpontjai lehetnek a gyulladásos válaszban szereplő sejtek (T és B limfociták, antigén-prezentáló sejtek) felszíni markerei, amelyek blokkolása útján a T sejt aktiválódása (ko-stimuláció molekulái, CD28-CD80/CD86) meggátolható, illetve maga a sejt eliminálható (B sejt CD 20-marker).
2.1. A rheumatoid arthritis aktivitása
Az anatómiai károsodás a gyulladás következménye, a közvetlen cél ennek mérséklése. A gyulladás aktivitásának mérésére a napi gyakorlatban az Amerikai Reumatológus Társaság által összeállított „core set” szerint vizsgáljuk a duzzadt és nyomásérzékeny ízületek számát, az akut fázis proteinek termelődését jelző CRP-szintet vagy vörösvértest-süllyedést (a CRP érzékenyebb, de drágább), 10 cm-es VAS mérve a fájdalom intenzitását, valamint a beteg és az orvos globális véleményét a betegség aktivitásáról. Ezen paraméterek egy részéből egy összetett index, ún. betegség aktivitási score (DAS) képezhető.
A gyakorlatban a 28 ízület vizsgálatával nyert DAS 28-at alkalmazzuk. A DAS 28 esetében 3,2 alatt beszélünk mérsékelt, 3,2 és 5,1 között közepes és e felett magas gyulladásos aktivitásról. A bázisterápiás gyógyszerek adagjának titrálásával vagy több gyógyszer kombinálásával lehetőség szerint a DAS 28-at 3,2 alá kell szorítanunk. Az optimális eredmény természetesen a teljes remisszió elérése lenne, ez a DAS 28 esetében 2,6 alatti értéket jelent. A DAS szoros kontrolljával végzett, ez által irányított kezelés bizonyítottan eredményesebben mérsékli az anatómiai károsodás ütemét, mint a betegek hagyományos gondozása.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
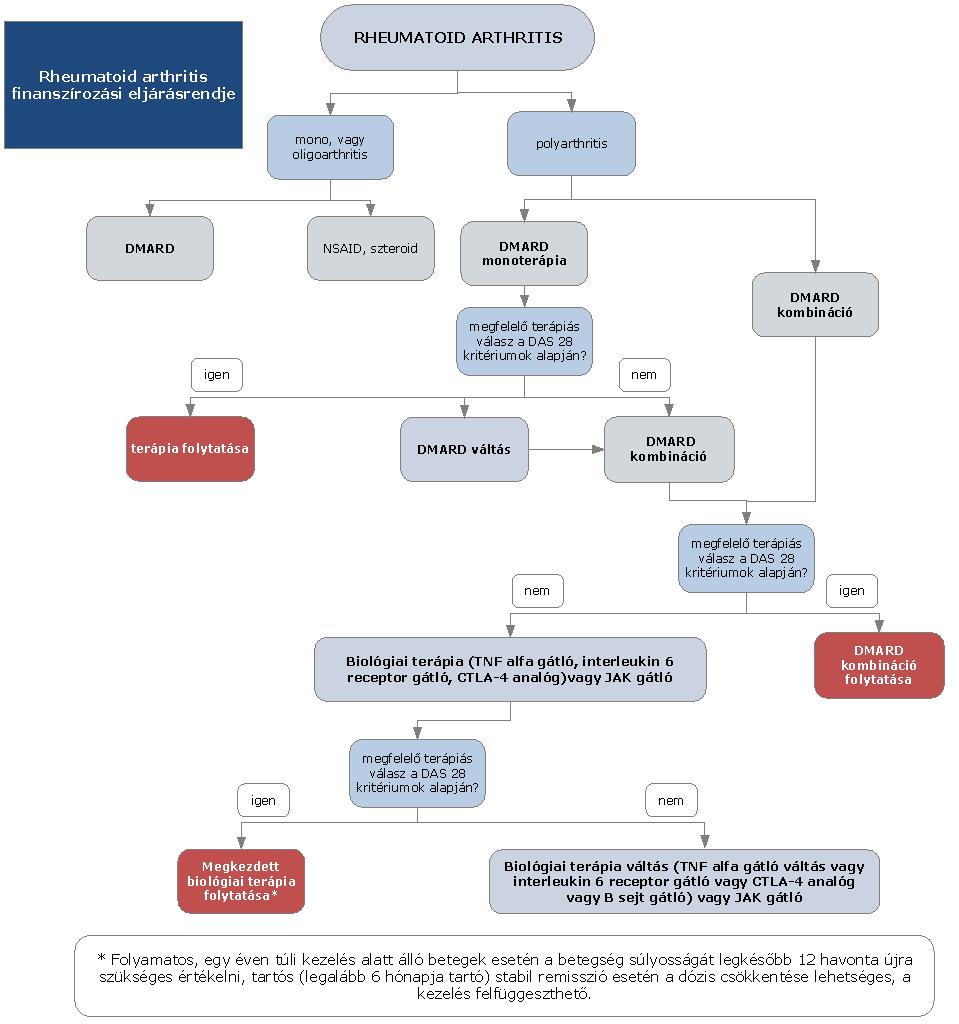
4. A rheumatoid arthritis gyógyszeres kezelési algoritmusa
Az algoritmus általánosságban mindegyik arthritis típusban alkalmazható, a speciális szempontok figyelembevételével.
4.1. Tüneti kezelés (analgetikum, NSAID) (alapellátás + mindhárom progresszivitási szint)
4.2. Kezdeti szteroid kezelés (6 hónapig adható, lásd alább) (mindhárom reumatológiai szint)
4.2.1. ilyenkor betegségmódosító hatása van
4.2.2. infekció, szeptikus arthritis kizárása szükséges
4.3. Korai betegségmódosító terápia (mindhárom reumatológiai szint) optimálisan a folyamat első 3 hónapján belül
4.3.1. DMARD kombináció
4.3.1.1. a betegség aktivitásától függő DMARD kombináció
vagy
4.3.2. DMARD monoterápia
4.3.2.1. a methotrexat (MTX) az első választandó szer (kivétel: intolerancia, kontraindikációk)
4.3.2.2. ritka (mérsékelt aktivitás) esetben SSZ, chloroquin (CQ) is alkalmazható
4.3.2.3. MTX ineffektivitás, intolerancia esetén SSZ, LEF (LEF)
4.3.2.4. cyclosporin A (CsA), CQ, AZA
4.3.2.5. speciális esetben (vasculitis) CPH
4.4. Biológiai terápia (2. és 3. reumatológiai szint: biológiai terápia alkalmazására kijelölt intézmények)
4.4.1. valamelyik TNF-gátló (infliximab, etanercept, adalimumab, golimumab, certolizumab-pegol)
4.4.2. interleukin-6 receptor gátlók (tocilizumab, sarilumab)
4.4.3. CTLA-4 analóg (abatacept)
4.4.4. 3 hónapig alkalmazott teljes dózisú vagy tolerálható dózisú DMARD kombinációs kezelés hatástalansága esetén engedélyezett társadalombiztosítási támogatással
4.5. Célzott szintetikus DMARD
JAK gátlók: baricitinib, tofacitinib, upadacitinib
4.6. Autológ őssejttranszplantáció (opcionálisan, nem rutinszerű)
5. Rheumatoid arthritis biológiai kezelése
5.1. A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
5.2. Indukciós és fenntartó kezelés súlyos rheumatoid arthritis esetén
5.2.1. Újonnan diagnosztizált aktív rheumatoid arthritis esetén elsőként választandó a DMARD monoterápia, alkalmazása javasolt gyors dózisemeléssel a megfelelő klinikai hatás eléréséig, vagy kombinációs terápia (beleértve a methotrexátot és legalább egy másik DMARD készítményt és rövid idejű kortikoszteroidot együttesen) a tünetek megjelenésétől számítva a lehető legrövidebb időn belül (<3 hónap).
5.2.2. Súlyos, aktív rheumatoid arthritis esetén az anti-TNF-α terápia (infliximab, etanercept, adalimumab, golimumab, certolizumab pegol) vagy interleukin-6 receptor gátlók (tocilizumab, sarilumab), CTLA-4 analóg (abatacept) terápia alkalmazható azon betegek számára, akiknél az alábbi kritériumok együttesen teljesülnek:
5.2.2.1. RA diagnózisa: több, mint 4 ACR kritérium együttesen van jelen az alábbiak közül legalább 3 hónapja:
5.2.2.1.1. Reggeli ízületi merevség (>1óra)
5.2.2.1.2. Három vagy több ízületi régió gyulladása
5.2.2.1.3. A kéz ízületeinek gyulladása legalább egy régióban
5.2.2.1.4. Szimmetrikus ízületi gyulladás
5.2.2.1.5. Rheumatoid csomók
5.2.2.1.6. Radiológiai elváltozások: eróziók, sávos dekalcifikáció a kézfelvételen
5.2.2.1.7. Rheumatoid faktor jelenléte a szérumban
5.2.2.2. 1 hónap eltéréssel legalább két alkalommal DAS 28 aktivitási index 5,1-nél nagyobb,
5.2.2.3. legalább 3 hónapig tartó DMARD kombinációban történő alkalmazás ellenére megfelelő terápiás válasz nem volt elérhető (DAS 28 aktivitási index 5,1-nél nagyobb),
5.2.2.4. a methotrexat (hacsak nem kontraindikált) alkalmazásra került a DMARD kombináció részeként,
5.2.2.5. a megfelelő DMARD kombinációs terápia ideje minimum 3 hónap, ebből legalább 2 hónap standard dózisban, hacsak a dózisemelés toxicitás miatt nem kivitelezhető.
5.2.3. Az indukciós anti-TNF-α terápiát követően legalább 3 havonta szükséges a DAS 28 index értékelése.
5.2.3.1. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető. A biológiai terápia leépítése a hagyományos DMARD terápia folytatása mellett javasolt.
5.2.4. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek (DAS 28 nem javult legalább 1,2 ponttal), másik anti-TNF-α terápiára történő váltás (switch), IL6 receptor gátlók (tocilizumab, sarilumab), CTLA-4 analóg (abatacept) vagy B sejt gátló (rituximab) kezelés megengedett. Switch-et követően, hatástalanság esetén további TNF-α gátló szerre nem érdemes váltani.
5.2.5. Az anti-TNF-α terápia nem folytatható, amennyiben anti-TNF-α terápia ellenére 6 hónap alatt megfelelő terápiás válasz nem volt elérhető (DAS 28 nem javult legalább 1,2 ponttal): primer hatástalanság.
5.2.6. Anti-TNF-α kezelés során a terápiás válasz elvesztése után vagy intolerancia esetén másik szerre való váltás megengedett: szekunder hatástalanság.
5.2.7. Az interleukin-6 receptor gátlók (tocilizumab, sarilumab ) és a CTLA-4 analóg (abatacept) terápiák alkalmazásának feltételei megegyeznek az anti-TNF-α terápia alkalmazásának feltételeivel.
5.2.8. B sejt gátló (rituximab) terápia methotrexattal kombinálva azon súlyos, aktív rheumatoid arthritisben szenvedő betegek kezelésében javasolt, akiknél TNF-α terápiára nem alakult ki megfelelő terápiás válasz vagy intolerancia jelentkezett.
5.2.9. B sejt gátló (rituximab) terápia methotrexattal kombinálva mindaddig folytatandó, amíg a megfelelő terápiás válasz fennáll. A megfelelő válasz kritériuma a következő: a betegség aktivitási index (DAS 28) javulás legalább 1,2 a kiindulási értékhez képest. Fenntartó terápia minimum 6 hónap múlva alkalmazható ismételten.
5.2.10. Az RA kezelésében az anti-TNF-α terápia és az interleukin-6 receptor gátló terápiák dózisának emelése csak az alkalmazási előírásokban foglaltak szerint javasolt.
5.2.11. A kijelölt centrumban, RA kezelésében jártas, megfelelő tapasztalattal rendelkező reumatológus szakorvos kompetenciája az anti-TNF-α, az interleukin-6 receptor gátló és a B sejt gátló (rituximab) terápia indikálása és alkalmazása.
5.3. Célzott szintetikus DMARD terápia (JAK gátlók)
5.3.1. Közepesen súlyos vagy súlyos aktív RA esetén azon betegeknél, akik esetében a 3 hónapig alkalmazott kombinációs DMARD (beleértve a metothrexátot, vagy hatástalanság és intolerancia esetén a leflunomid alkalmazást is) kezelés ellenére a DAS28 szerinti betegségaktivitás magas, illetve egyéb rossz prognosztikai faktorok (seropozitivitás, vagy struktúrális izületi károsodás, vagy magas betegség aktivitás, vagy kettő vagy több konvencionális DMARD kezelés hatástalansága vagy intoleranciája) állnak fenn.
5.3.2. A JAK gátlók alkalmazása a biológiai terápiát követően kezdhető meg.
6. Szövődmények monitorozása, ellenőrzése TNF-α gátló kezelés, interleukin-6 receptor gátló-, valamint JAK gátló terápiák alkalmazása esetén
6.1. Opportunista infekciók
6.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
6.1.2. Különös gondot kell fordítani
6.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux);
6.1.2.2. további, krónikus bakteriális infekció kizárására;
6.1.2.3. 5 éven belüli malignus betegség kizárására;
6.1.2.4. a fizikális vizsgálatra;
6.1.2.5. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
6.1.2.6. A kezelés időtartama alatt
6.1.2.6.1. félévente mellkas röntgen szükséges,
6.1.2.6.2. tuberculosis monitorizálása (latens TBC esetén),
6.1.2.6.3. hepatitis B szerológiai szűrés a kockázatos betegek esetében.
6.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
6.3. Malignus betegségek
6.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
6.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
6.4. Neurológiai eltérések
6.4.1. Nervus opticus neuritis
6.4.2. Demyelinizációs kórképek
6.5. Kardiális állapot
6.5.1. NYHA III-IV. stádiumú kardiális elégtelenség esetén biológiai terápia nem indítható. A kezelés során a kardiális elégtelenség monitorozása szükséges.
6.6. Graviditás
6.6.1. A beteg figyelmét fel kell hívni a teratogén kockázatra és ezért az effektív antikoncepció szükségességére.
6.7. Egyéb mellékhatások
6.7.1. Infúziós/injekciós helyi reakciókkal kell számolni.
6.7.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. Szakmai ellenőrzési pontok
7.2.1. A diagnózis kritériumainak rögzítése (BNO: M06.9)
7.2.2. 4 ACR kritérium együttes jelenléte az alábbiak közül:
7.2.2.1. Reggeli ízületi merevség (>1 óra)
7.2.2.2. Három vagy több ízületi régió gyulladása
7.2.2.3. A kéz ízületeinek gyulladása legalább egy régióban
7.2.2.4. Szimmetrikus ízületi gyulladás
7.2.2.5. Rheumatoid csomók
7.2.2.6. Radiológiai elváltozások: eróziók, sávos dekalcifikáció a kézfelvételen
7.2.2.7. Rheumatoid faktor jelenléte a szérumban (RF faktor) (Labor)
7.2.3. A betegség aktivitásának meghatározása (aktivitási index DAS 28) és dokumentálásának ellenőrzése
7.2.3.1. súlyos: 5,1 felett a DAS 28 aktivitási index (módosított Disease Activity Score)
7.2.3.2. középsúlyos: 5,1 és 3,2 között a DAS 28 aktivitási index
7.2.3.3. enyhe: 3,2 alatt a DAS 28 aktivitási index
7.2.4. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
7.2.4.1. TBC kizárása (mellkas RTG)
7.2.4.2. Fertőzések kizárása
7.2.4.3. Malignus betegség kizárása
7.2.4.4. Demyelinizációs betegség, SLE kizárása anamnesztikus adatok, klinikum alapján
7.2.4.5. Terhesség kizárása
7.2.4.6. Kongesztív szívelégtelenség kizárása (NYHA III-IV.)
7.2.4.7. Labor (rutin, immun): (RF, anti-CCP, ANA)
7.2.5. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
7.2.5.1. Indukciós kezelés alatt havonta, fenntartó kezelés alatt 3 havonta: labor (We, Fvs, CRP opcionális, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
7.2.5.2. 3 havonta: aktivitási index (DAS 28)
7.2.5.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
7.2.5.4. Tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
7.2.6. Megjegyzés
7.2.6.1. Elfogadott DMARD terápiák: metothrexat (MTX), LEF (LEF), SSZ, cyclosporin. A CsA, chloroquin (CQ), AZA speciális esetben (vasculitis) CPH alkalmazásakor a forgalomba hozatali engedély indikációit szükséges figyelembe venni
7.2.6.2. Elfogadott DMARD kombinációk: bármely szakmailag elfogadott DMARD kombináció alkalmazható
7.2.6.3. TNF alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével), golimumab, certolizumab pegol
7.2.6.4. Interleukin-6 receptor gátlók: tocilizumab, sarilumab
7.2.6.5. B sejt gátló: rituximab
7.2.6.6. CTLA-4 analóg: abatacept
7.2.6.7. Célzott szintetikus DMARD terápia (JAK gátlók): baricitinib, tofacitinib, upadacitinib
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása, monitorozása.
8.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Táblázat: Releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
BNO |
BNO megnevezése |
|
2 |
M0500 |
Felty-syndroma |
|
3 |
M0510 |
Rheumatoid tüdőbetegség (J99.0*) |
|
4 |
M0520 |
Rheumatoid érgyulladás |
|
5 |
M0530 |
Rheumatoid arthritis más szervek és szervrendszerek érintettségével |
|
6 |
M0580 |
Egyéb seropositiv rheumatoid arthritis |
|
7 |
M0590 |
Seropositiv rheumatoid arthritis, k.m.n. |
|
8 |
M0600 |
Seronegativ rheumatoid arthritis |
|
9 |
M0610 |
Felnőttkori kezdetű Still-betegség |
|
10 |
M0630 |
Rheumatoid csomó |
|
11 |
M0640 |
Gyulladásos polyarthropathia |
|
12 |
M0620 |
Rheumatoid bursitis |
|
13 |
M0680 |
Egyéb, meghatározott rheumatoid arthritis |
|
14 |
M0690 |
Rheumatoid arthritis, k.m.n. |
9.2. Táblázat: Releváns ATC kódok
|
|
A |
B |
C |
D |
|
|
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
1 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
|
2 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
|
3 |
L04AA13 |
LEF |
DMARD |
Betegségmódosító szerek |
|
4 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
|
5 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
|
6 |
P01BA01 |
chloroquin |
DMARD |
Betegségmódosító szerek |
|
7 |
L04AB01 |
etanercept |
TNF alfa gátló |
Biológiai terápia eszközei |
|
8 |
L04AA24 |
abatacept |
CTLA-4 analóg |
Biológiai terápia eszközei |
|
9 |
L04AA29 |
tofacitinib |
JAK gátló |
Betegségmódosító szerek |
|
10 |
L04AA37 |
baricitinib |
JAK gátló |
Betegségmódosító szerek |
|
11 |
L04AA44 |
upadacitinib |
JAK gátló |
Betegségmódosító szerek |
|
12 |
L04AB02 |
infliximab |
TNF alfa gátló |
Biológiai terápia eszközei |
|
13 |
L04AB04 |
adalimumab |
TNF alfa gátló |
Biológiai terápia eszközei |
|
14 |
L04AB06 |
golimumab |
TNF alfa gátló |
Biológiai terápia eszközei |
|
15 |
L04AB05 |
certolizumab-pegol |
TNF alfa gátló |
Biológiai terápia eszközei |
|
16 |
L04AC07 |
tocilizumab |
IL-6 R gátló |
Biológiai terápia eszközei |
|
17 |
L04AC14 |
sarilumab |
IL-6 R gátló |
Biológiai terápia eszközei |
|
18 |
L01XC02 |
rituximab |
B sejt gátló |
Biológiai terápia eszközei |
|
19 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
|
20 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
21 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
22 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
10. Fogalmak, rövidítések
RA Rheumatoid arthritis
ATC Anatomical therapeutic chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
ACR American College of Rheumatology
DAS Disease activity score
VAS Vizuális analóg skála
DMARD Disease modifying antirheumatic drug
TNF Tumor nekrózis faktor
CRP C-reaktív protein
MTX Methotrexat
CsA ciklosporin A
LEF Leflunomid
SSZ Szulfaszalazin
CQ Chloroquin
CPH Cyclophosphamid
AZA Azathioprin
NSAID Non-steroid anti-inflammatory drug
JAK Janus-kináz
12. melléklet a 31/2010. (V. 13.) EüM rendelethez24
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Juvenilis idiopathias arthritis
2. A kórkép leírása
A 16 éves kor előtt kezdődő, legalább 6 hete fennálló, legalább 1 ízületet érintő, ismeretlen eredetű, vagyis egyéb okkal nem magyarázható ízületi gyulladás esetén beszélünk juvenilis idiopathiás arthritisről (JIA).
2.1. A betegség felosztása
2.1.1. Szisztémás forma
2.1.2. Oligoarticularis forma
2.1.3. Polyarticularis lefolyású forma – rheumatoid factor pozitív
2.1.4. Polyarticularis lefolyású forma – rheumatoid factor negatív
2.1.5. Arthritis psoriatica
2.1.6. Enthesitishez kapcsolódó arthritis
2.1.7. Nem besorolható
2.2. A főbb klinikai formák közül a polyarticularis JIA-ban (30%) 5 vagy több ízületet érintő, általában szimmetrikus polyarthritis (kéz és láb kisízületek, nyaki gerinc érintettsége) jelentkezik, az esetek egyharmadában rheumatoid faktor pozitivitással. A lány-fiú arány 3:1. Az oligoarticularis JIA (50%) általában az alsó végtagok nagyízületeit (típusosan térdet, bokát) érintő, aszimmetrikus, rheumatoid faktor negatív oligoarthritis. Ebben a formában fordul elő leggyakrabban chronicus uveitis, különösen antinukleáris antitest jelenlétében. Leggyakrabban 1 és 4 éves kor között jelentkezik, lányoknál gyakoribb (4:1).
A szisztémás JIA (10%) lázzal, szisztémás tünetekkel (naponta visszatérő magas láz, tranziens erythemas maculosus kiütések, generalizált lymphadenopathia, hepatosplenomegalia, pericarditis) jár. A betegség extrém ritka 6 hónapos kor előtt, leggyakoribb 1-4 éves kor között, de bármely életkorban megjelenhet, fiúkat és lányokat egyenlő arányban érint.
A juvenilis arthritis psoriatica sokféle klinikai megjelenést mutathat, típusos a kis- és nagyízületeket aszimmetrikusan érintő oligo- vagy polyarthritis, a DIP ízületi érintettség, illetve a kolbászujj jelenség. Psoriasisos köröm jelenségek (Beau-pontok, onycholysis), illetve elsőfokú rokon psoriasisa a családi anamnézisben segít a diagnózis felállításában. Az enthesitishez kapcsolódó formában a betegek jelentős részénél sacroileitis alakul ki, esetenként gerinc érintettséggel, gyakori HLA-B27 asszociációval. A psoriasis itt kizáró kritérium.
2.3. A juvenilis idiopathias arthritis aktivitását Giannini javulási kritériumai szerint az alábbi paraméterek alapján értékeljük:
2.3.1. aktív ízületek száma
2.3.2. mozgáskorlátozott ízületek száma
2.3.3. az orvos általános értékelése a betegség aktivitásáról (VAS)
2.3.4. a beteg vagy a szülő / törvényes képviselő általános értékelése a betegség aktivitásáról (VAS)
2.3.5. CHAQ (Childhood Health Assessment Questionnaire)
2.3.6. We (mm/h)
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
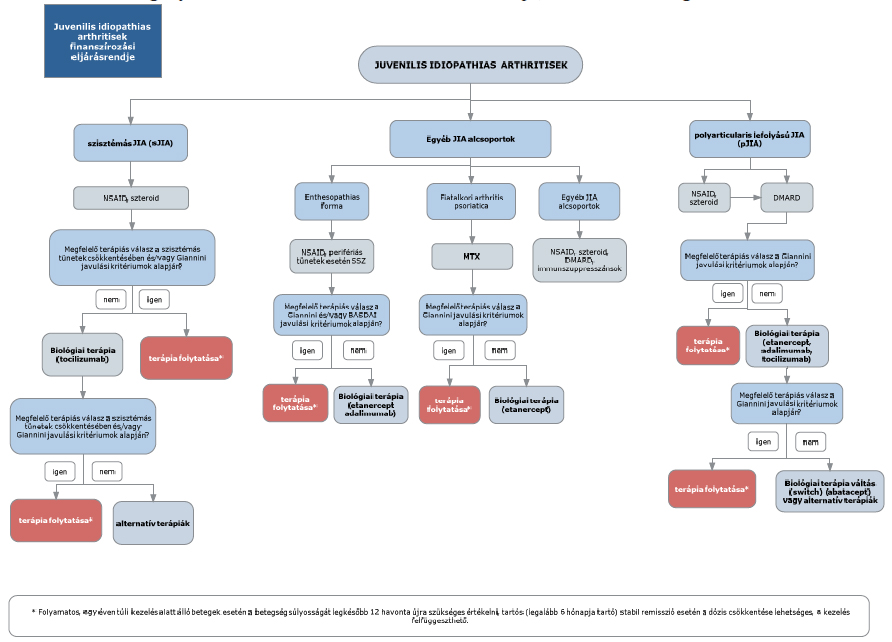
4. A juvenilis idiopathias arthritis gyógyszeres kezelési algoritmusa
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
4.1. Szisztémás JIA (sJIA)
4.1.1. tüneti kezelés: analgetikum, NSAID
4.1.2. szteroid kezelés
4.1.3. infekció, szeptikus arthritis kizárása szükséges
4.1.4. biológiai terápia: NSAID és szisztémás szteroid kezelés hatástalansága esetén: tocilizumab (2. és 3. reumatológiai szint: biológiai terápiás centrumok)
4.2. Polyarticularis lefolyású JIA (pJIA)
4.2.1. tüneti kezelés (analgetikum, NSAID) (alapellátás + mindhárom progresszivitási szint) (a folyamat kezdetén maximum 2-3 hónapig, illetve később fellángolás esetén rövid ideig)
4.2.2. szteroid kezelés (mindhárom reumatológiai szint)
4.2.3. Betegségmódosító terápia (mindhárom reumatológiai szint)
4.2.3.1. A methotrexat (MTX) az első választandó szer (kivétel: intolerancia). A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
4.2.3.2. ritka (nagyon enyhe) esetben szulfaszalazinnal (SSZ) is indíthatunk. A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
4.2.4 Betegségmódosító terápia hatástalansága esetén biológiai terápia (2. és 3. reumatológiai szint: biológiai terápiás centrumok) – TNF-alfa gátló (etanercept vagy adalimumab) vagy IL-6 receptor-antagonista (tocilizumab).
4.2.5. Legalább egy TNF-alfa gátló hatástalansága esetén CTLA-4 analóg (abatacept) (2. és 3. reumatológiai szint: biológiai terápiás centrumok).
4.3. Egyéb JIA alcsoportok
4.3.1. tüneti kezelés (analgetikum, NSAID)
4.3.2. szteroid kezelés
4.3.3. betegségmódosító terápia (DMARD: pl. MTX, SSZ, immunszuppresszánsok)
4.3.4. biológiai terápia (etanercept)
4.3.5. A kezelések alkalmazása a diagnosztizált egyes alcsoportok (enthesopathiás forma, fiatalkori arthritis psoriatica, egyéb alcsoportok) szerint történik. (Lsd. 3. pont folyamatábra)
5. Indukciós és fenntartó kezelés súlyos juvenilis idiopathias arthritis esetén
5.1. Juvenilis idiopathias arthritis esetén biológiai terápia (etanercept, adalimumab vagy tocilizumab) indítható, ha a betegség poliartikuláris formája áll fenn, és a beteg legalább 3 hónapig adott 15 mg/m2/hét methotrexát kezelés ellenére aktív, azaz 5 vagy több ízület duzzadt és 3 vagy több ízület mozgáskorlátozott, fájdalmas, érzékeny, illetve a beteg állapota 0,25 mg/kg/nap vagy ennél nagyobb szteroid adag mellett is a fentiek szerint aktív. Indokolt a biológiai terápia akkor is, ha a felsorolt kezelések toxikusnak bizonyultak vagy nem tolerálhatók.
5.2. Biológiai terápia (tocilizumab) indítható a betegség szisztémás formájában, ha nem-szteroid gyulladásgátló vagy szisztémás szteroid adására nincs kellő terápiás válasz a szisztémás tünetek csökkenése (vörösvérsejt süllyedés, CRP, láz) és /vagy a Giannini kritériumok alapján.
5.3. Biológiai terápia indítható a juvenilis arthritis psoriatica (etanercept) és az enthesopathiás formák (etanercept vagy adalimumab) esetén is, ha az előbbi esetében methotrexatra, utóbbi esetében axiális érintettség esetén nem-szteroid gyulladásgátló kezelésre, perifériás tünetek esetén szulfaszalazinra nincs kielégítő terápiás válasz a Giannini kritériumok alapján a 3. hónapban esedékes értékeléskor.
5.4. Különös figyelemmel kell lenni minden esetben a készítmények alkalmazási előírásában szereplő indikációs területekre és az életkorra vonatkozó előírásokra. Biológiai terápia esetén a dózis emelése csak az alkalmazási előírásokban foglaltak szerint javasolt.
5.5. Csak a gyermekkori reumatológiai betegségek diagnosztizálásában és kezelésében jártas reumatológus szakorvosok kompetenciája a biológiai terápia indikálása és alkalmazása gyermekgyógyász konzíliárus bevonásával.
5.6. A Giannini javulási kritériumok összetevőit meg kell határozni a kezelés kontrollja során. Megfelelő válaszkészség esetén (Giannini javulási kritérium mértéke 30%-nál magasabb, vagyis legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladja meg a romlás a 30%-ot) az aktivitás rendszeres kontrollja mellett a remisszió fennállásáig folytatható a terápia.
5.7. Az sJIA tocilizumab kezelésénél az általános klinikai tüneteket is figyelembe kell venni (Giannini kritériumok mellett láz hiánya, gyulladásos laborparaméterek normalizálódása).
Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
5.8. A 18. életév betöltése után, amennyiben a betegség lefolyása kimeríti bármely felnőttkori krónikus arthritis klasszifikációját, a felnőttkori besorolás alkalmazandó és a diagnózis módosítandó.
6. Szövődmények monitorozása, ellenőrzése
6.1. Opportunista infekciók
6.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
6.1.2. különös gondot kell fordítani
6.1.2.1. a tuberculosis kizárására a kezelés megkezdése előtt és a kezelés időtartama alatt a szakmai irányelvben foglaltak szerint,
6.1.2.2. a fizikális vizsgálatra,
6.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
6.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
6.3. Malignus betegségek
6.3.1. malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott,
6.3.2. az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
6.4. Neurológiai eltérések
6.4.1. Nervus opticus neuritis
6.4.2. Demyelinizációs kórképek
6.5. Egyéb mellékhatások
6.5.1. Infúziós/injekciós helyi reakciókkal kell számolni.
6.5.2. Autoantitestek, főleg a kiméra, infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. Szakmai ellenőrzési pontok
7.2.1. A diagnózis kritériumainak rögzítése (BNO: M08.0)
7.2.1.1. 16 éves kor alatt
7.2.1.2. legalább 1 ízület érintett
7.2.1.3. az ízületi gyulladás tünetei legalább 6 hete fennállnak
7.2.1.4. egyéb, ismerten ízületi gyulladást okozó betegség kizárható
7.2.1.5. a 7 alcsoport valamelyikének meghatározása
7.2.1.6. radiológiai elváltozások identifikálása vagy kizárása (RTG)
7.2.1.7. rheumatoid faktor jelenléte a szérumban (RF faktor) (egyéb labor)
7.2.2. A betegség aktivitásának meghatározása (Giannini kritériumok) és dokumentálásának ellenőrzése
7.2.2.1. az orvos véleménye a betegségről (vizuális analóg skálával, VAS)
7.2.2.2. a beteg vagy szülő / törvényes képviselő véleménye a beteg állapotáról (VAS)
7.2.2.3. a gyermekkorra adaptált Health Assessment Questionnaire (CHAQ) értéke
7.2.2.4. a gyulladt ízületek száma
7.2.2.5. a mozgáskorlátozott ízületek száma
7.2.2.6. vörösvértest-süllyedés, illetve CRP
7.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
7.2.3.1. TBC kizárása
7.2.3.2. fertőzések kizárása
7.2.3.3. demyelinizációs betegség, SLE kizárása az anamnesis és klinikum alapján
7.2.3.4. labor (rutin, immun: RF, anti-CCP, ANA)
7.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
7.2.4.1. havonta: labor (Wgr, Fvs, CRP opcionális, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
7.2.4.2. 3 havonta: aktivitási index (Giannini)
7.2.4.3. TBC kizárása
7.2.4.4. tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
7.2.5. Megjegyzés
7.2.5.1. Elfogadott DMARD terápiák esetén a forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
7.2.5.2. TNF alfa gátlók: etanercept, adalimumab.
7.2.5.3. IL-6 receptor antagonista: tocilizumab.
7.2.5.4. Giannini 30% javulás: értékelhető javulásról akkor beszélünk, ha legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladhatja meg a romlás a 30%-ot.
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
Kód |
BNO megnevezése |
|
2 |
M0800 |
Fiatalkori reumás ízületi gyulladás |
|
3 |
M0810 |
Fiatalkori spondylitis ankylopoetica |
|
4 |
M0820 |
Szisztémás kezdetű juvenilis arthritis |
|
5 |
M0830 |
Fiatalkori seronegativ polyarthritis |
|
6 |
M0840 |
Kevés ízületet érintő fiatalkori ízületi gyulladás |
|
7 |
M0880 |
Egyéb fiatalkori ízületi gyulladás |
|
8 |
M0890 |
Fiatalkori ízületi gyulladás, k.m.n. |
|
9 |
M0900 |
Fiatalkori ízületi gyulladás psoriasisban |
9.2. Releváns ATC kódok
|
|
A |
B |
C |
D |
|---|---|---|---|---|
|
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
|
3 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
|
4 |
L04AA13 |
leflunomid |
DMARD |
Betegségmódosító szerek |
|
5 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
|
6 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
|
7 |
P01BA01 |
chloroquin |
DMARD |
Betegségmódosító szerek |
|
8 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
9 |
L04AA24 |
abatacept |
CTLA-4 analóg |
Biológiai terápia eszközei |
|
10 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
11 |
L04AC07 |
tocilizumab |
IL-6 RA |
Biológiai terápia eszközei |
|
12 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
|
13 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
14 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
15 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
10. Fogalmak, rövidítések
|
|
A |
B |
|---|---|---|
|
1 |
Rövidítés |
Megnevezés |
|
2 |
JIA |
Juvenilis idiopathiás arthritis |
|
3 |
ATC |
Anatomical therapeutic chemical klasszifikáció |
|
4 |
BNO |
Betegségek nemzetközi osztályozása |
|
5 |
VAS |
Vizuális analóg skála |
|
6 |
CHAQ |
Childhood health assessment questionnaire |
|
7 |
DMARD |
Disease modifying antirheumatic drug |
|
8 |
TNF |
Tumor nekrózis faktor |
|
9 |
CRP |
C-reaktív protein |
|
10 |
MTX |
Methotrexat |
|
11 |
SSZ |
Szulfaszalazin |
|
12 |
NSAID |
Non-steroid anti-inflammatory drug |
13. melléklet a 31/2010. (V. 13.) EüM rendelethez25
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Spondylitis ankylopoetica
2. A kórkép leírása
2.1. A spondylitis ankylopoetica (SPA) meghatározás szerint a gerinc ízületeit érintő, ismeretlen eredetű, következményes elcsontosodással járó gyulladás. A gyulladás a tőízületeket, perifériás ízületeket és az íntapadási helyeket is érintheti. Jellemző a folyamatos, éjszaka fokozódó gerinc- (keresztcsonti, derék-, hát-, majd nyak-) fájdalom, a következményes ankylosis miatt a gerinc mozgásainak beszűkülése. Gerincérintettségen szimmetrikus sacroileitist és spondylitist értünk, perifériás formában a tőízületeken (csípő, váll) kívül a térdek, bokák, kézízületek érintettek leggyakrabban. Az extraskeletális tünetek közül a szem (anterior uveitis), szív-érrendszer (aortitis, aorta insufficientia, ingerületvezetési block), tüdő (kevert ventillációs zavar, felső lebeny fibrosis), amyloidosis emelhetők ki. Az örökletesség mértéke 72%, főleg a HLA-B27 génnek van jelentősége. A betegség férfiak között 4-5-ször gyakrabban fordul elő. A kezdet többnyire a 15-30 éves korra esik. Az esetek 70%-ában csak a gerinc és a tőízületek (sacroiliacalis ízületek, csípők) érintettek, 30%-ban perifériás érintettség (általában alsó végtagi mono- vagy oligoarthritis, enthesitis, illetve dactylitis) áll fenn. A betegség lefolyására jellemző, hogy viszonylag fiatal korban kezdődik és korán irreverzibilis ízületi károsodásokkal jár, melyek a tanulást, a szociális beilleszkedést és a munkavállalást is megnehezítik.
2.2. Az SPA terápiája elsősorban tüneti (NSAID, gyógytorna, pszicho-szociális támogatás). A biológiai terápia révén a tüneteket hatékonyan befolyásoló, a progressziót csökkentő, a betegség kimenetelét kedvezőbben befolyásoló kezelés áll rendelkezésre. A biológiai terápia csak azon betegek esetében kezdhető el, akiknél a módosított New York-i klasszifikációs kritériumok szerint a biztos diagnózis fennállása igazolt, radiológiailag legalább 2-es stádiumú bilaterális, vagy 3-as, 4-es stádiumú unilaterális sacroileitis, és legalább 3 hónapja háti fájdalom, frontális és sagittalis síkban beszűkült gerinc-, illetve beszűkült légzőmozgás áll fenn. A biológiai terápia elkezdésének további feltétele az adekvát gyógyszeres kezelés ellenére igazoltan fennálló aktív betegség. Adekvát gyógyszeres kezelésről akkor beszélhetünk, ha legalább két különböző, nem szteroid gyulladásgátló maximális vagy tolerálható dózisban történő, legalább 4 hétig tartó adagolása ellenére a betegség aktivitása nem csökken. Amennyiben a beteg fő panasza az SPA-hoz tartozó perifériás ízületi gyulladás, akkor további feltétel, hogy enthesitis, oligoarthritis esetében lokális vagy intraarticularis kortikoszteroid kezelés, polyarthritis esetében a rheumatoid arthritis kezelésében alkalmazott DMARD (elsősorban a szulfaszalazin megfontolandó szer) legalább négy hónapos gyógyszeres terápia ellenére is az aktív betegség fennálljon.
2.3. A betegség aktivitását a BASDAI index-szel határozzuk meg. Aktívnak tekinthető azon, SPA-ban szenvedő beteg, akinek a BASDAI indexe (0-100) több mint 40. A sacroiliacalis ízületek MR vizsgálata a betegség korai diagnózisának, tudományos vizsgálatokban az aktivitásának, a hagyományos RTG felvétel a betegség radiológiai progressziójának megítélését teszik lehetővé. Perifériás érintettségű SPA aktivitását a DAS 28 index-szel határozhatjuk meg.
2.4. A terápia további alkalmazásának eldöntése céljából a biológiai terápia hatásosságát és biztonságosságát rendszeresen ellenőrizni kell. A terápia hatásosnak tekinthető, amennyiben a megkezdett kezelést követő 12-14. hétre legalább 50%-os relatív BASDAI index csökkenés vagy az index 20 mm abszolút csökkenése igazolható. Amennyiben ez a feltétel nem teljesül, akkor a biológiai terápiát az adott készítménnyel nem lehet tovább folytatni. A BASDAI indexet a kezelés folyamán két-három havonta szükséges ellenőrizni. Ha legalább két egymást követő alkalommal az eredmény a 12-14. héten elért javuláshoz képest romlik (az index érték emelkedik), a kezelést szintén meg kell szakítani.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
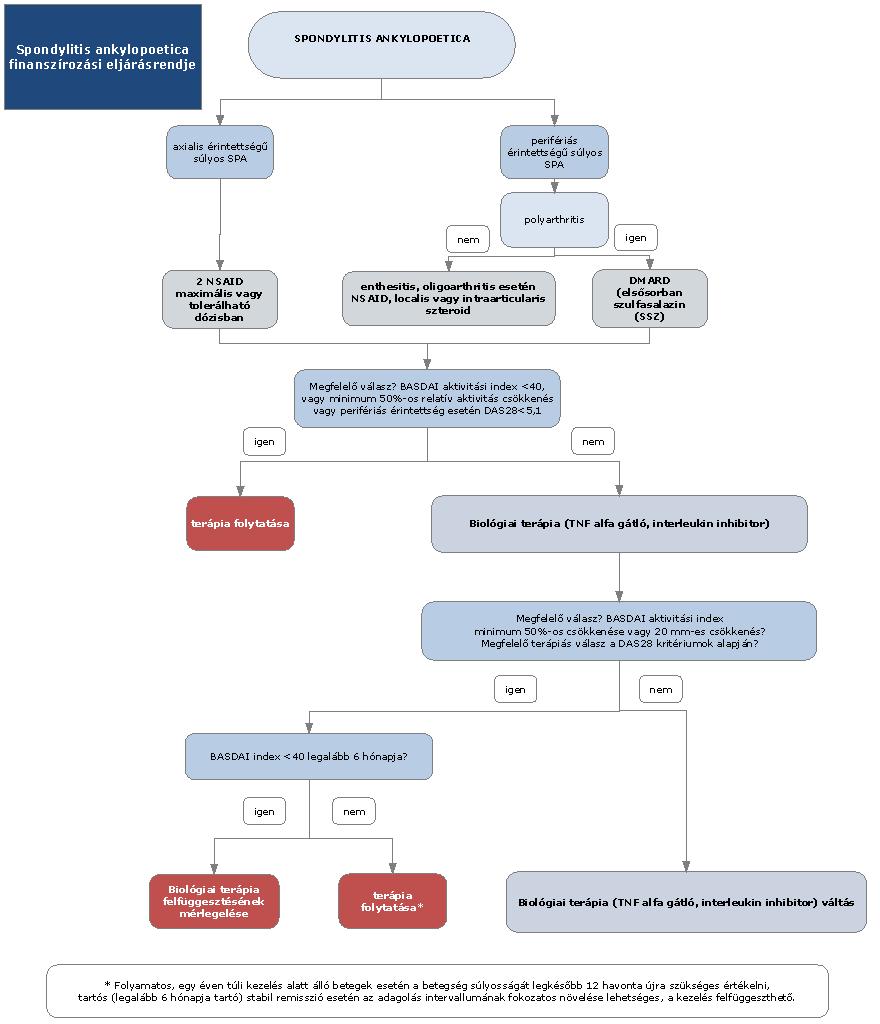
4. A finanszírozási eljárásrend részletezése
4.1. A spondylitis ankylopoetica gyógyszeres kezelési algoritmusa
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
4.1.1. Tüneti kezelés (NSAID analgetikum) (alapellátás + mindhárom progresszivitási szint) tartósan vagy fellángolás esetén rövid ideig
4.2. Perifériás érintettségű SPA
4.2.1. NSAID
4.2.2. Lokális, illetve szükség szerint intraarticularis szteroid kezelés (minimum 2 alkalommal) (mindhárom reumatológiai szint)
4.2.3. Infekció, szeptikus arthritis kizárása szükséges
4.2.4. Korai betegségmódosító terápia (mindhárom reumatológiai szint) (perifériás érintettség esetén jön szóba)
4.2.5. Optimálisan a folyamat első 3 hónapján belül
4.2.6. SSZ az elsőként javasolható szer (kivétel: intolerancia, kontraindikáció)
4.3. Axiális érintettségű SPA
4.3.1. NSAID készítmény alkalmazása, legalább 2 különböző készítmény maximális vagy tolerálható dózisban legalább 4 hétig
4.4. Biológiai terápia
4.4.1. Perifériás érintettségű súlyos SPA során DMARD (elsősorban szulfaszalazin) terápia, illetve súlyos axialis érintettségű SPA-ban alkalmazott legalább 2 NSAID hatástalansága esetén: biológiai terápia (2. és 3. reumatológiai szint: biológiai terápia alkalmazására kijelölt intézmény).
4.4.2. Valamelyik TNF-α gátló: infliximab (az alkalmazott támogatási kategória figyelembevételével), etanercept, adalimumab, golimumab, certolizumab-pegol.
4.4.3. Interleukin 17 inhibitor: szekukinumab
4.5. Indukciós kezelés súlyos spondylitis ankylopoetica esetén
4.5.1. A kezelés előtt rögzíteni kell:
4.5.1.1. A BASDAI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egyhónapos időközzel.
4.6. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése spondylitis ankylopoetica kezelésében
4.6.1. A kezelés 12-14. hetében meg kell határozni a BASDAI index összetevőit. Amennyiben a kiindulási értékhez képest legalább 50%-kal vagy 20 mm-rel nem javult az index átlaga, a biológiai terápia az adott készítménnyel nem folytatható. A BASDAI indexet a kezelés folytatása során legalább két-három havonta mérni kell.
4.6.2.
4.6.3.
4.7. Interleukin inhibitor kezelés szempontjai
4.7.1. A javasolt adag kezdő adagolásként a 0., 1., 2., 3. és 4. héten 150 mg szubkután injekcióban, melyet a 4. héttől kezdve havonkénti fenntartó adagolás követ. A klinikai válaszreakció rendszerint 16 hetes kezelés alatt kialakul. A kezelés abbahagyása mérlegelendő azoknál a betegeknél, akik 16 hetes kezelés alatt nem mutattak válaszreakciót.
4.7.2. A terápia megkezdését különösen mérlegelni szükséges krónikus, recurrens fertőzésekben szenvedő betegeknél, Crohn-betegségben, esedékes védőoltások és egyéb terápiák esetén (pl. immunszupresszánsok, UV fototerápia) az alkalmazási előírásban foglaltak szerint.
4.8. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén az adagolás intervallumának fokozatos növelése lehetséges, a kezelés felfüggeszthető.
4.9. Csak szakavatott és a terápia alkalmazásában jártas, kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α és az interleukin inhibitor terápia indikálása és alkalmazása.
5. Szövődmények monitorozása, ellenőrzése
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
5.1.2. Különös gondot kell fordítani
5.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
5.1.3. A kezelés időtartama alatt félévente mellkas röntgen szükséges.
5.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.3. Malignus betegségek
5.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.3.3. Malignus folyamat esetén 10 éves túlélést követően kezdhető biológiai terápia. A bőr basaliomája esetén a várakozási idő 5 év.
5.4. Neurológiai betegségek (fennállásuk esetén a biológiai terápia kontraindikált)
5.4.1. Nervus opticus neuritis
5.4.2. Demyelinizációs kórképek
5.5. Kardiális állapot
5.5.1. NYHA III-IV. stádiumú kardiális elégtelenség esetén biológiai terápia nem indítható.
5.5.2. A kezelés során a kardiális elégtelenség monitorozása szükséges.
5.6. Graviditás
5.6.1. A beteg figyelmét fel kell hívni a teratogén kockázatra és ezért az effektív antikoncepció szükségességére.
5.7. Egyéb mellékhatások
5.7.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.7.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
6. Fenntartó kezelés spondylitis ankylopoetica biológiai kezelésében
6.1. A kezelés további folytatása során legalább két-három havonta rögzíteni kell a BASDAI indexet, amennyiben a paraméterek két egymást követő alkalommal sem érik el a 12-14. héten már elért legalább 20 mm-es csökkenést vagy 50%-os javulást (ami a folytatás feltétele), akkor a kezelést hatástalanság miatt abba kell hagyni.
7. Laboratóriumi vizsgálatok: célja az egyéb, a biológiai terápiákkal párhuzamosan felírt betegség-módosító gyógyszerek hatásvizsgálata.
7.1. Mielőtt megkezdjük a terápiát, vizsgálni kell:
7.1.1. teljes vérképet
7.1.2. vizeletet
7.1.3. elektrolitokat
7.1.4. májfunkciós értékeket
7.1.5. antinukleáris antitesteket (ANA)
7.1.6. anti-DNS-t
7.1.7. hepatitis szerológiát
8. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
8.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
8.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
8.1.2. Betegadatok (online TAJ ellenőrzés)
8.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
8.2. Szakmai ellenőrzési pontok
8.2.1. A biológiai terápia elkezdéséhez szükséges kritériumok rögzítése (BNO: M45.H0)
8.2.1.1. 2-es stádiumú bilateralis vagy
8.2.1.2. 3-as, 4-es stádiumú unilateralis sacroiletitis (radiológiai vizsgálat)
8.2.1.3. legalább 3 hónapja mozgásra mérséklődő háti fájdalom
8.2.1.4. frontális (nem mérhető objektíven) és szagittális síkban beszűkült gerincmozgás
8.2.1.5. beszűkült légzőmozgás
8.2.2. A betegség aktivitásának meghatározása (BASDAI INDEX 0-100) és dokumentálásának ellenőrzése
8.2.2.1. BASDAI index (0-100) több, mint 40
8.2.2.2. klinikai tünetek súlyossága
8.2.2.3. akut fázis fehérjék magas szintje (laborvizsgálat)
8.2.2.4. gyors radiológiai progresszió (RTG felvétel)
8.2.2.5. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel opcionális)
8.2.2.6. tartós 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
9. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
9.1. A területre fordított közkiadások alakulása.
9.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
10. A finanszírozás szempontjából lényeges finanszírozási kódok
10.1. Releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
Kód |
BNO megnevezése |
|
2 |
M0810 |
Fiatalkori spondylitis ankylopoetica |
|
3 |
M45H0 |
Spondylitis ankylopoetica |
10.2. Releváns ATC kódok
|
|
A |
B |
C |
D |
|
|
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
1 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
|
2 |
L04AB02 |
infliximab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
3 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
4 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
5 |
L04AB05 |
certolizumab-pegol |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
6 |
L04AB06 |
golimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
7 |
L04AC10 |
szekukinumab |
IL 17 inhibitor |
Biológiai terápia eszközei |
|
8 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
|
9 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
10 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
11 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
11. Fogalmak, rövidítések
|
|
A |
B |
|---|---|---|
|
1 |
Rövidítés |
Megnevezés |
|
2 |
SPA |
Spondylitis ankylopoetica |
|
3 |
ATC |
Anatomical Therapeutic Chemical klasszifikáció |
|
4 |
BNO |
Betegségek nemzetközi osztályozása |
|
5 |
DAS |
Disease activity score |
|
6 |
BASDAI |
Bath ankylosing spondylitis disease activity index |
|
7 |
DMARD |
Disease modifying antirheumatic drug |
|
8 |
TNF |
Tumor nekrózis faktor |
|
9 |
SSZ |
Szulfaszalazin |
|
10 |
NSAID |
Non-steroid anti-inflammatory drug |
|
11. |
IL |
Interleukin |
14. melléklet a 31/2010. (V. 13.) EüM rendelethez26
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Arthritis psoriatica
2. A kórkép leírása
2.1. Az arthritis psoriatica (AP) egy krónikus szisztémás gyulladásos reumatológiai megbetegedés, mely a bőr psoriasisos elváltozásával társul. Az arthritis többnyire aszimmetrikus és jellemző a disztális interphalangeális ízületek érintettsége, az ujjak kolbászszerű duzzanata (dactylitis). A betegség bármely perifériás ízületet, a gerinc kisízületeit, a sacroiliacalis ízületeket és a szalagtapadási helyeket (enthesis) érintheti. Extraskeletalis érintettség (szem, szív-érrendszer, tüdő) előfordulhat. A kórkép diagnosztikája, kezelése és a betegség nyomon követése a bőrgyógyász és a reumatológus szakorvost egyaránt érinti. Az AP kórisméjét az elfogadott kritériumrendszerrel (Moll-Wright, CASPAR) igazolni kell.
2.2. Az arthritis psoriatica aktivitása
2.2.1. Az arthritis psoriaticában szenvedő beteg perifériás túlsúlyú arthritisének értékelésére a DAS 28 index, axiális érintettség aktivitásának mérésére a BASDAI index alkalmazható. A bőrérintettség kiterjedésének és súlyosságának értékelésére plakkos psoriasisban a PASI score elfogadott.
2.2.2. Axiális érintettség esetén a betegség aktivitását a BASDAI index-szel határozzuk meg. Aktív, súlyosnak tekinthető azon arthritis psoriaticában szenvedő beteg, akinek a BASDAI index (0-100) átlaga több mint 40, és az axiális érintettség fennállását radiológiai vizsgálatokkal igazolták. A sacroiliacalis ízületek MR vizsgálata a betegség aktivitásának, a hagyományos RTG felvétel a betegség radiológiai progressziójának megítélését teszik lehetővé.
2.2.3. Perifériás érintettség esetén a betegség aktivitását DAS 28 index-szel határozzuk meg. Súlyos, aktívnak tekinthető azon arthritis psoriaticában szenvedő beteg, akinek a DAS 28 értéke nagyobb, mint 5,1.
2.2.4. Bőrérintettség súlyosságának megítélésére a PASI index alkalmazható. A bőrtünetek kiterjedtsége, lokalizációja és jellege alapján enyhe vagy középsúlyos psoriasisról beszélünk, amennyiben a PASI<15. Nagyobb kiterjedésű elváltozásról akkor beszélünk, ha a PASI>15. Nagyon ritkán bőrtünet nélkül is előfordulhat arthritis psoriatica.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
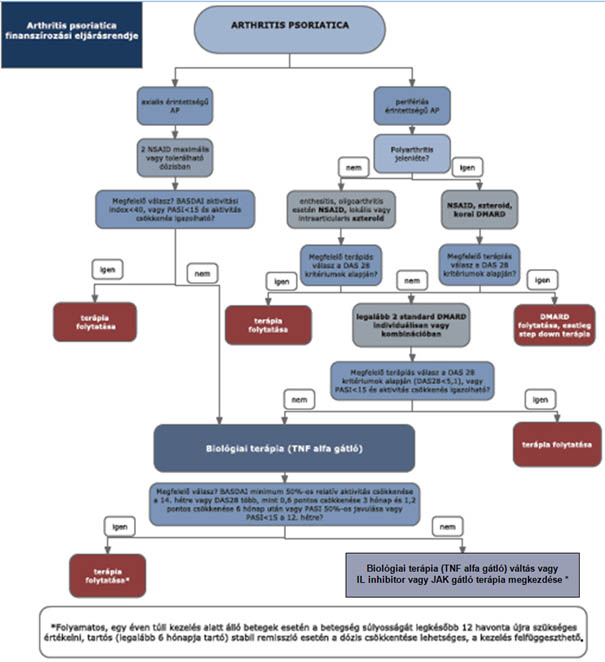
4. Az arthritis psoriatica kezelése
4.1. A psoriasis kezelése a bőrgyógyász, az arthritis kezelése a reumatológus feladata, ezért az arthritis psoriatica kezelésében a két szakma képviselőinek együttműködése szükséges. Az arthritis psoriatica kezelése kezdetben nem-szteroid gyulladáscsökkentők, esetleg kis dózisú szteroid adása, ezek eredménytelensége esetén betegségmódosító gyógyszerek (DMARD) bevezetése. Ma perifériás érintettségű arthritis psoriaticában a methotrexat az első DMARD választás, a LEF, ciklosporin A (CsA) és SSZ is alkalmazható. (A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.)
4.2. A terápia további alkalmazásának eldöntése céljából a terápia hatásosságát rendszeresen ellenőrizni kell. A betegség jellegéből kifolyólag az érintettségtől függően a reumatológiában alkalmazott score-ok (axiális érintettség esetén BASDAI, perifériás érintettség esetén DAS 28) használhatóak a betegség súlyosságának megállapításához. Súlyos bőrérintettség esetén a PASI score felvétele elengedhetetlen, értékét a PASI mérésében gyakorlott személy (bőrgyógyász, de akár reumatológus vagy képzett asszisztens) állapíthatja meg.
4.3. Az arthritis psoriatica biológiai kezelése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
4.3.1. Indukciós kezelés súlyos, aktív arthritis psoriaticában
4.3.2. Axiális érintettség esetén a kezelés előtt rögzíteni kell:
4.3.2.1. A BASDAI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel.
4.3.3. Axiális érintettség esetén biológiai terápia indokolt, amennyiben
4.3.3.1. a Bath ankylosing spondylitis disease activity index (BASDAI) nagyobb, mint 40 és
4.3.3.2. súlyos bőrérintettség esetén a PASI nagyobb, mint 15
4.3.3.3. konvencionális, legalább 3 hónapig tartó, legalább 2 nonszteroid (NSAID) gyulladáscsökkentő terápia maximális vagy tolerálható dózisban történő alkalmazása ellenére a betegség aktivitásában megfelelő terápiás válasz nem volt elérhető.
4.3.4. Perifériás érintettség esetén a kezelés előtt rögzíteni kell:
4.3.4.1. a DAS 28 index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel. A biológiai terápia indításakor a lemért paramétereket rögzíteni szükséges.
4.3.5. Perifériás érintettség esetén biológiai terápia indokolt, amennyiben:
4.3.5.1. a DAS 28 nagyobb, mint 5,1 és legalább 3 hónapig tartó, 2 konvencionális standard DMARD vagy legalább 3 hónapig tartó DMARD kombinációs terápia ellenére megfelelő javulás, aktivitáscsökkenés nem volt regisztrálható.
4.3.6. Súlyos bőrérintettség esetén a PASI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel. A biológiai terápia indításakor a lemért paramétereket rögzíteni szükséges.
4.3.7. Súlyos bőrérintettség esetén biológiai terápia indokolt, amennyiben:
4.3.7.1. súlyos bőrérintettség esetén (PASI nagyobb, mint 15) biológiai terápia bőrgyógyászati javallatra is indokolt a psoriasis finanszírozási eljárásrendje szerint. Amennyiben mind az ízületi aktivitás, mind a psoriasis kiterjedése és súlyossága alapján biológiai kezelés bevezetése indokolt, a reumatológus és a bőrgyógyász szakorvos dokumentált közös döntése alapján indul, majd követendő nyomon a biológiai kezelés.
4.4. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése arthritis psoriatica kezelésében
4.4.1. Axiális érintettség
4.4.1.1. A kezelés 14. hetében meg kell határozni a BASDAI index összetevőit. Amennyiben a kiindulási értékhez képest legalább 50%-kal vagy 20 mm-rel nem javult az index átlaga, a biológiai terápia nem folytatható.
4.4.2. Perifériás érintettség
4.4.2.1. A terápia hatásosságának értékelésére szintén a gyulladásos aktivitás objektív és nemzetközileg elfogadott mértékeként a DAS 28 rendszer alkalmazása javasolt. A válaszkészség mértékét az EULAR javulási kritériumai szerint kell meghatározni. A gyulladásos aktivitás értékelése és a mellékhatások regisztrálása háromhavonta szükséges.
4.4.2.2. Elsődleges hatástalanság: ha a TNF-α gátlás során a javulás a kezelés 3. hónapjában kisebb, mint 0,6 DAS 28 pont, a kezelés 6. hónapjában kisebb, mint 1,2 DAS 28 pont.
4.4.2.3. Másodlagos, „szerzett” rezisztencia: ha a korábban hatásos biológiai kezelés (a DAS 28 index csökkenése 3 hónap után minimum 0,6 és 6 hónap után minimum 1,2 pont) után az aktivitás ismét megemelkedik (a DAS 28 a kiindulási értékhez képest kevesebb, mint 1,2 ponttal alacsonyabb).
4.4.3. Súlyos bőrérintettség
4.4.3.1. A terápia hatásosságának értékelésére szintén a gyulladásos aktivitás objektív és nemzetközileg elfogadott mértékeként a PASI alkalmazása javasolt.
4.4.3.2. Nem megfelelő terápiás válaszról beszélünk akkor, ha a 12. hétre nem következik be PASI<15 vagy a PASI érték minimum relatív 50%-os javulása.
4.5. Fenntartó kezelés az arthritis psoriatica biológiai kezelésében
4.5.1. A kezelés további folytatásának eldöntése céljából háromhavonta rögzíteni kell a BASDAI (axiális érintettség esetén), DAS 28 (perifériás érintettség esetén), PASI (súlyos bőrérintettség esetén) indexeket. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.6. A biológiai terápiás kezelés további folytatásának kritériumai:
4.6.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α terápiára történő váltás (switch), IL inhibitor vagy JAK gátló terápia megkezdése megengedett.
4.6.2. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben meghatározott induló dózishoz képest nem javasolt.
4.6.3. Csak szakavatott és a terápia-alkalmazásban jártas kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α, az IL inhibitor és JAK gátló terápia indikálása és alkalmazása.
4.7. Laboratóriumi vizsgálatok: célja az egyéb, a biológiai terápiákkal párhuzamosan felírt betegség-módosító gyógyszerek hatásvizsgálata. Mielőtt a terápia megkezdődik, vizsgálni kell:
4.7.1. We/CRP-t,
4.7.2. teljes vérképet,
4.7.3. vizeletet,
4.7.4. elektrolitokat,
4.7.5. májfunkciós értékeket,
4.7.6. antinukleáris antitesteket (ANA),
4.7.7. anti-DNS-t.
5. Szövődmények monitorozása, ellenőrzése
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
5.1.2. Különös gondot kell fordítani
5.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
5.1.3. A kezelés időtartama alatt félévente mellkas röntgen szükséges.
5.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel, és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.3. Malignus betegségek
5.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.4. Neurológiai eltérések
5.4.1. Nervus opticus neuritis
5.4.2. Demyelinizációs kórképek
5.5. Egyéb mellékhatások
5.5.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.5.2. Autoantitestek, főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
6. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. Kompetencia szint: intézményi, szakorvosi kompetencia ellenőrzése
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. A diagnózis kritériumainak rögzítése (BNO: L40.5, M07.0-M07.3)
6.2.1.1. Moll-Wright vagy CASPAR kritériumok alapján
6.2.1.2. Perifériás érintettség: DAS 28 aktivitási index dokumentálása
6.2.1.3. Axiális érintettség: BASDAI index dokumentálása
6.2.1.4. Dermális érintettség: PASI index dokumentálása
6.2.2. A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése
6.2.2.1. BASDAI index (0-100) átlaga több mint 40 (axiális érintettség esetén) vagy
6.2.2.2. DAS 28 index nagyobb mint 5,1 (perifériás érintettség esetén) vagy
6.2.2.3. PASI index nagyobb mint 15 (súlyos bőrérintettség esetén)
6.2.2.4. klinikai tünetek súlyossága
6.2.2.5. akut fázis fehérjék magas szintje (laborvizsgálat)
6.2.2.6. gyors radiológiai progresszió (RTG felvétel)
6.2.2.7. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel opcionálisan)
6.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
6.2.3.1. TBC kizárása (mellkas RTG)
6.2.3.2. Fertőzések kizárása
6.2.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok és klinikum alapján)
6.2.3.4. Terhesség kizárása
6.2.3.5. Életvitel módja (fertőzésveszély)
6.2.3.6. NYHA III-IV. stádiumú szívelégtelenség
6.2.3.7. Malignus betegség 10 éven belül (kivéve basalioma: 5 éven belül)
6.2.3.8. Labor: rutin
6.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
6.2.4.1. Indukciós kezelés alatt havonta, fenntartó kezelés alatt 3 havonta: WE, CRP (opcionális), vérkép, GOT, GPT, GGT, CN, Kreat, ionok, vizelet vizsgálat javasolt
6.2.4.2. 3 havonta: aktivitási index (BASDAI vagy DAS 28 vagy PASI index meghatározása és dokumentálása)
6.2.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
6.2.4.4. Tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
6.2.5. Megjegyzés
6.2.5.1. Elfogadott DMARD terápiák: methotrexat (MTX), LEF, SSZ, cyclosporin A (CsA), a készítmények forgalomba hozatali engedélyében szereplő indikációkat figyelembe kell venni
6.2.5.2. Elfogadott DMARD kombinációk: MTX intolerancia esetén bármely elfogadott DMARD kombináció alkalmazható
6.2.5.3. TNF alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével), golimumab
6.2.5.4. IL inhibitor: szekukinumab, ixekizumab, guszelkumab
6.2.5.5. JAK-gátló: tofacitinib
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A területre fordított közkiadások alakulása, monitorozása.
7.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. táblázat: Releváns BNO kódok
|
|
A |
B |
|---|---|---|
|
1 |
BNO |
BNO megnevezése |
|
2 |
M0700 |
Distalis interphalangealis ízületet érintő arthropathia psoriatica |
|
3 |
M0710 |
Arthritis mutilans (L40.5+) |
|
4 |
M0720 |
Spondylitis psoriatica (L40.5+) |
|
5 |
M0730 |
Egyéb psoriasisos arthropathiák (L40.5+) |
8.2. táblázat: Releváns ATC kódok
|
|
A |
B |
C |
D |
|---|---|---|---|---|
|
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
|
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
|
3 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
|
4 |
L04AA13 |
LEF |
DMARD |
Betegségmódosító szerek |
|
5 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
|
6 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
7 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
8 |
L04AB02 |
infliximab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
9 |
L04AB06 |
golimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
|
10 |
L04AC10 |
szekukinumab |
IL-inhibitor |
Biológiai terápia eszközei |
|
11 |
L04AC13 |
ixekizumab |
IL-inhibitor |
Biológiai terápia eszközei |
|
12 |
L04AC16 |
guszelkumab |
IL-inhibitor |
Biológiai terápia eszközei |
|
13 |
L04AA29 |
tofacitinib |
JAK gátló |
Betegségmódosító szerek |
|
14 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
|
15 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
|
16 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
|
17 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
9. Fogalmak, rövidítések
|
AP |
Arthritis psoriatica |
|
ATC |
Anatomical therapeutic chemical klasszifikáció |
|
BNO |
Betegségek nemzetközi osztályozása |
|
EULAR |
European League Against Rheumatism |
|
DAS |
Disease activity score |
|
BASDAI |
Bath ankylosing spondylitis disease activity index |
|
PASI |
Psoriasis area and severity index |
|
DMARD |
Disease modifying antirheumatic drug |
|
TNF |
Tumor nekrózis faktor |
|
IL |
Interleukin |
|
CRP |
C-reaktív protein |
|
MTX |
Methotrexat |
|
CsA |
Ciklosporin A |
|
LEF |
Leflunomid |
|
SSZ |
Szulfaszalazin |
|
NSAID |
Non-steroid anti-inflammatory drug |
15. melléklet a 31/2010. (V. 13.) EüM rendelethez27
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Oszteoporózis patológiás csonttörés nélkül (M81.0 – M81.9)
1.2. Oszteoporózis máshova osztályozott betegségekben (M82.0, M82.1, M82.8)
2. A kórkép leírása
2.1. Az oszteoporózis (csontritkulás) a csontváz generalizált, progresszív metabolikus megbetegedése, amelyben csontszövet szerves és szervetlen állományának arányos fogyása, ezáltal a csonttömeg megfogyatkozása, a csont finomszerkezetének károsodása és a csontminőség romlása a csont teherbíró képességének és rugalmasságának csökkenéséhez, fokozott törékenységhez vezet. Emiatt a csonttörések gyakoribbá válnak, mivel az oszteoporózisos csont eltörésének kockázata már kis erőbehatás esetén is fokozott. Az oszteoporózis következtében kialakult csípőtáji törés vagy combnyak-törés közvetlen életveszélyt jelenthet, de az egyéb csonttörések is jelentős mértékben ronthatják az életminőséget és fokozzák a mortalitást. A csonttörések idős korban egyre gyakoribbak, így jelentős népegészségügyi problémát és társadalmi költséget jelentenek. Nőknél, posztmenopauzában kezdetben a trabekuláris csontvesztés dominál, melyhez az életkor előrehaladtával kortikális csontvesztés társul.
2.2. Az oszteoporózis következtében fellépő csonttörések típusos helyei kezdetben:
2.2.1. a csigolyák és
2.2.2. az orsócsont disztális vége, majd idősebb korban válnak egyre gyakoribbá
2.2.3. a felkarcsont proximális törései és
2.2.4. a csípőtáji törések.
2.3. Ugyanakkor a klinikai gyakorlatban a csontváz bármely részén kis erőbehatásra bekövetkező csonttörés – lokalizációtól függetlenül – típusos oszteoporotikus törésnek minősül.
2.4. Legtöbbször a betegség involúciós (posztmenopauzális és szenilis) formáival találkozhatunk, de egyre nő a szekunder oszteoporózisok előfordulása is, amelyeket más szervek betegségei vagy gyógyszerek okoznak.
2.5. Az oszteoporózis népbetegség, az Európai Vertebralis Osteoporosis Tanulmány (EVOS) szerint hazánkban megközelítőleg 600 ezer nőt és 300 ezer férfit érint az 50 év feletti korosztályban. Más nemzetközi adatok szerint Európában az 50 éven felüli nők között 2-ből 1, a férfiak között 5-ből 1 szenved oszteoporózisban. A csontritkulás klinikai jelentőségét a kóros csonttörés és annak szövődményei adják, azon belül is a legnagyobb jelentőségűek a csípőtáji törések. Egyes felmérések szerint a csípőtáji töröttek több mint 30%-a a fraktúra utáni első évben meghal, mintegy fele élete végéig ellátási segítségre szorul, s csupán minden ötödik beteg gyógyul teljesen. A csigolyatörések zöme fokozatosan keletkezik, és sokáig rejtve marad, csupán az esetek tizede kerül azonnal észlelésre.
2.6. Az oszteoporózis terápiája alapvetően a törések megelőzésére irányul. Az oszteoporózis multifaktoriális betegség, de az egyes tényezők egymáshoz való viszonya még kevéssé tisztázott. Mind az oszteoporózis, mind az oszteoporózisos csonttörés kialakulásának kockázatát több tényező növelheti, egyes tényezők mindkettőt. A terápiát igénylő betegek a csonttörés rizikófaktorainak és a csont-denzitás meghatározása alapján azonosíthatóak be.
2.7. A legfontosabb validált törési rizikótényező az életkor. A 80 év feletti populációban történik a csonttörések 25%-a. A másik legfontosabb kockázati tényező a csökkent ásványi csonttömeg. Az oszteoporózis további legfontosabb rizikófaktorai a női nem, a kis testtömeg vagy 10%-nál több testtömeg elvesztése, tartós immobilizáció, korábbi oszteoporotikus csonttörés, oszteoporózisra pozitív családi anamnézis, kollagén keresztkötés magas szérum (vizelet) szintje, szteroidok tartós szedése, dohányzás, alkoholizmus, reumatoid arthritis. Ezek a rizikófaktorok nőknél a posztmenopauzás életszakaszban a legjelentősebbek, de nem egyformán hangsúlyosak.
2.8. Az oszetoporotikus törések kockázati tényezőit az alábbi táblázat foglalja össze.
2.8.1. Egy csigolya kompressziója (több mint 25%-os magasságcsökkenése)
2.8.2. Többszörös csigolyakompresszió
2.8.3. Bármilyen korábbi oszteoporotikus törés
2.8.4. 65 év feletti életkor
2.8.5. Szekunder hyperparathyreosishoz vezető kórképek
2.8.6. Hypogonadismus
2.8.7. Tartós (három hónapot meghaladó) oralis glükokortikoid (több mint napi 7,5 mg prednizolonnal ekvivalens) kezelés
2.8.8. Cushing szindróma
2.8.9. Szubklinikus hypercortisolismus
2.8.10. Primer hyperparathyreosis
2.8.11. Glitazon kezelés
2.8.12. Non-vertebrális törés 50 év felett
2.8.13. Aromatáz inhibitor kezelés
2.8.14. Androgéndeprivációs kezelés
2.8.15. Reumatoid arthritis
2.8.16. Spondylarthritis ankylopoetica
2.8.17. Proximális femurtörés a szülőknél
2.8.18. Soványság (BMI kevesebb mint 20 kg/m2)
2.8.19. Dohányzás
2.8.20. Többszörös esés
2.8.21. Immobilizáció
2.8.22. Epilepsia (antiepileptikus kezelés)
2.8.23. Gyomor-, bélresectio
2.8.24. Diabetes mellitus (1. és 2. típus)
2.8.25. TSH szintje alacsonyabb, mint 0,3 mU/l
2.8.26. Elesési kockázatot növelő gyógyszerek szedése (szedatívumok, antidepresszánsok, neuroleptikumok, orthostatist okozó gyógyszerek)
2.8.27. Kezeletlen korai (45 éves kor előtt kezdődő) menopauza
2.8.28. Minimum 4 egység alkohol fogyasztása naponta (1 alkohol egység 8-10 g alkoholt jelent, ami szeszes italban kifejezve 1 pohár sör, 1 dl bor, 2 cl rövidital)
2.8.29. Csípőtörés a szülői anamnézisben
2.8.30. Fokozott csontturnover
2.9. Az Egészségügyi Világszervezet (WHO) munkacsoportja validált kockázati tényezők alapján egy rizikóbecslő rendszert alakított ki, amely integrálja a páciens egyes kockázati tényezőivel kapcsolatos veszélyeztetettségét, és megadja az oszteoporotikus törés 10 éves valószínűségét. A FRAX® (Fracture Risk Assessment Tools) a combnyak BMD, a kor, a nem, a BMI, az előző törések, a családban korábban előfordult csípőcsont-törés, dohányzás, alkoholfogyasztás, glükokortikoid kezelés, rheumatoid arthritis, illetve szekunder osteoporosis megléte alapján ország specifikusan becsüli meg a rizikót. A FRAX-modellt több tízezer európai, amerikai, ázsiai és ausztrál beteg csont-sűrűségi és törési adatainak feldolgozásával fejlesztették ki. A számítógépes algoritmus az interneten bárki számára hozzáférhető (http://www.shef.ac.uk/FRAX), és az adott ország törési statisztikáinak felhasználásával kiszámítható az adott beteg törési kockázata. A FRAX a magyar betegek vonatkozásában hazai adatok alapján végzi a számítást.
2.10. Az oszteoporózis kezelésének és a kóros csonttörések megelőzésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai aktivitás. Szükség esetén gyógyszeres terápiával lehet a csontritkulás folyamatát gátolni.
2.11. Primer prevenció alatt azon posztmenopauzás nők és 55 év feletti férfiak kezelése értendő, akiknek fokozott kockázatuk van kóros csonttörésre, és a gyógyszeres kezeléssel ez a kockázatuk csökkenthető.
2.12. Jelen finanszírozási eljárásrend a posztmenopauzás nők és 55 év feletti férfiak oszteoporózis miatt kialakuló csonttörésének primer megelőzését célzó kezelését határozza meg, nem foglalja magába a csontritkulást szűrő programokat.
3. Diagnosztika
3.1. Az ásványi csonttömeg denzitometriás módszerekkel pontosan megmérhető. A mért csontsűrűséget (BMD, bone mineral density, g/cm2) az egészséges fiatalok átlagértékéhez, a csúcs-csonttömeghez (PBM, peak bone mass) hasonlítják, és a különbséget a fiatal populáció normál értékének szórásában (SD) fejezik ki (T-score). Leggyakrabban az alacsony energiájú röntgensugárzással végzett képalkotó eljárást (DEXA; Dual Energy X-Ray Absorptiometry) használják. Ezen kívül alkalmazzák az ultrahangos csontsűrűség mérést és a kvantitatív komputertomográfiát is, az előbbi társadalombiztosítás által nem támogatott, utóbbit csak kutatásokhoz kapcsolódóan jelentik az engedéllyel rendelkező szolgáltatók. A javasolt mérési helyek elsősorban az ágyéki gerinc, csípőtájék, további lehetőség az alkar, sarok és kézujjak.
3.2. Az oszteoporózis diagnózis felállításának alapvető feltétele a T-score érték meghatározása. Az oszteoporózist azoknál jelenthetjük ki, akiknél ez az érték -2,5-nél kisebb. Az Egészségügyi Világszervezet ajánlása szerint az alábbi diagnosztikus kategóriákat állíthatjuk fel a T-score értéke alapján:
3.2.1. T-score nagyobb, mint –1,0 SD = egészséges csontozat
3.2.2. T-score –1,0 és –2,5 SD közötti = oszteopénia
3.2.3. T-score kisebb, mint –2,5 SD = oszteoporózis
3.2.4. T-score kisebb, mint –2,5 SD és legalább egy oszteoporózis miatti csonttörés = súlyos oszteoporózis
3.3. Oszteoporózis esetén a csontsűrűség törzscsontokon való mérését a társadalombiztosítás finanszírozza. A diagnosztikus eljárás a 3570C Csontsűrűség mérése törzscsontokon (törzsi csontok ásványianyag tartalmának fotonabsorptiós meghatározása) OENO kóddal jelenthető. A vizsgálat oszteoporózis esetén 12 havonta egyszer számolható el -2,5 vagy kisebb (rosszabb) T-score érték melletti specifikus törés prevenciós gyógyszeres kezelés esetén.
3.4. A végtagcsontokon történő csontsűrűség mérést a társadalombiztosítás kizárólag thyreotoxcosis és primer hyperparathyreosis esetén finanszírozza, melyet a közfinanszírozott szolgáltatók a 3570A Csontsűrűség mérése végtagcsontokon [bármely végtagcsont (alkar, sarok, tibia, stb.) ásványianyag tartalmának fotonabsorptiós meghatározása] OENO kóddal jelenthetnek.
3.5. A kvantitatív CT-vel történő csontsűrűség mérés közfinanszírozásba nem befogadott eljárás, de az engedélyezett orvosbiológiai kutatásokhoz kapcsolódóan a 3570D Csontsűrűség mérése pQCT-vel (végtagcsontok ásványianyag tartalmának meghatározása quantitativ computer tomographiával) OENO kódon jelenteni kell a Nemzeti Egészségbiztosítási Alapkezelő felé.
3.6. A kezelőorvos számára a laboratóriumi vizsgálatok (Ca, P, PTH, D-vitamin, TSH) a csökkent BMD kóreredetének elkülönítésében, a csont-turnover markereinek (a reszorpció és formáció biomarkerei, elsősorban a szérum és vizelet kollagén keresztkötést tartalmazó peptidjeinek és csontspecifikus alkalikus foszfatáznak) a meghatározása a terápia-választásban segíthetnek.
4. Terápia
4.1. Kalcium és D-vitaminpótlás
4.1.1. A primer prevencióban az oszteoporózis kezelésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai mozgás. Epidemiológiai vizsgálatok bizonyítják, hogy az adekvát kalcium- és D-vitamin bevitel gyermekeknél a csúcs-csonttömeg kialakulásában, időseknél a csontvesztés megelőzésében és a törési, illetve az esési kockázat csökkentésében játszik szerepet.
4.1.2. A fizikai aktivitás stimulálja az oszteoblasztokat, továbbá az izomerő javulásával az elesések száma is csökken. Preventív céllal, illetve oszteopénia eseteiben a rendszeres megfelelő intenzitású és frekvenciájú testedzés ajánlott. Ez a gyakorlatban minimum heti háromszori alkalommal végzett aerobik jellegű, ütközéssel járó mozgásformát jelent. A nagyobb csontmennyiség kialakulását elsősorban a pubertás kor előtt elkezdett fizikai aktivitás segíti elő a terhelésnek kitett csontokon.
4.1.3. Fontos prevenciós tényező az immobilizáció kerülése, az immobilitás megszüntetése lehetőség szerint 7 napon belül, továbbá az eséskockázat csökkentése. Ez utóbbi alatt elsősorban a beteg környezetének a botlások, elcsúszások elkerülése miatti akadálymentesítését, illetve fokozott esési kockázat esetén az egyéb (pl. esési kockázatokhoz vezető gyógyszeres kezelés) okok feltárását és életmódbeli változtatással annak elkerülését értjük (pl. megfelelő szemüveg viselése, altató korai bevételének kerülése, stb.). Az életkörülmények célszerű átalakítása önmagában 50%-kal csökkenti a törési kockázatot. Prevenciós hatása van még a napi minimum 30 perc szabad levegőn eltöltött időnek, napfény expozícióval, a megfelelő kalória-, kalcium-, B12 vitamin- és folsavbevitelnek, továbbá a dohányzás elhagyásának.
4.1.4. A megfelelő kalcium bevitel elengedhetetlenül fontos a normális növekedéshez, a maximális csúcs csonttömeg kialakulásához, valamint a felnőttkori csontanyagcsere egyensúlyának fenntartásához. A javasolt napi kalcium bevitel napi 1000 mg, de legfeljebb 1200 mg. A kalcium bevitel további fokozása káros következményekkel járhat, napi 2000 mg felett fokozódik a törések gyakorisága, férfiak esetében 1300-1500 mg felett fokozódik a prostata carcinoma incidenciája. Magyarországon egy felnőtt személy átlagos napi kalcium fogyasztása 400-600 mg közötti. Célszerű az ajánlott mennyiségeket étel formájában elfogyasztani, de ha természetes formában nem elégséges a kalcium bevitel, azt gyógyszeresen ki kell egészíteni. A gyógyszeres kalcium pótlásnál előnyben részesítendők a citrát sók. A citrát só előnye a pH-független felszívódás, a nagyobb biohasznosulás, a gastrointestinalis mellékhatások hiánya, illetve a citrát vizelettel történő ürülése során a kalcium vesekövesség elleni védelem. Meta-analízisek csökkent törési arányt mutattak ki olyan betegekben, akik legalább 80%-ban betartották a kalciumpótlás előírásait.
4.1.5. A D-vitaminhiány gyakorisága az életkor előrehaladtával párhuzamosan folyamatos növekedést mutat. A 65 év feletti lakosságnak legalább harmada D-vitaminhiányban szenved. Már a mérsékelt D-vitaminhiány csontritkulást okozhat. Kifejezett D-vitaminhiányról beszélünk, ha a szérum 25-OH-D-vitamin szint 12-15 ng/ml alatt van, idősek esetén azonban már a 25 ng/ml alatti érték is csontvesztéshez vezethet. Kimutatható, hogy a legalább napi 700-800 NE D-vitamin bevitele már segít megelőzni az idősebbek csípőtöréseit. Szakmai konszenzus alapján a megfelelő D-vitaminpótlás 800-2000 NE D3 vitamin naponta vagy ekvivalens dózisok hetente-többhetente. D-vitaminpótlás során rendszeresen kell ellenőrizni (1., 3., 6. hónapban, majd évente, illetve dózisváltáskor) a szérum kalcium szintjét és a vizelet kalciumürítést.
4.1.6. Kalcium és D-vitamin bevitel kiegészítő pótlása a társadalombiztosítás által akkor támogatott, ha a dokumentáltan gondozott posztmenopauzás nő vagy 55 év feletti férfi beteg oszteoporózisa igazolódott (BMD -2,5 SD T-score alatti), vagy nála a fokozott töréskockázati tényezőkből legalább három egyidejűleg bizonyítottan fennáll, vagy a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%). A szükséges kalcium és D-vitaminbevitel, amennyiben nincs ellenjavallata, az oszteoporózis terápiájának folyamatos követelménye, ugyanúgy a megfelelő életvitel kialakítása.
4.2. Biszfoszfonátok
4.2.1. A gyógyszeres terápia megválasztásánál fontos szempont, hogy a negatív csonthatások elkerülésére csak a valóban szükséges gyógyszerek szükséges és elegendő mennyiségű szedése történjen meg. A kezelés finanszírozási lépéseinek megválasztásánál az adott készítmény alkalmazási előiratát figyelembe kell venni.
4.2.2. A csontritkulás okozta kóros csonttörések primer és szekunder prevenciójában egyaránt az első választandó gyógyszerhatóanyag-csoport a biszfoszfonátok. A biszfoszfonátok erősen kötődnek a csontszövethez és gátolják az oszteoklasztok aktivitását, és azok apoptózisát okozzák, ezzel erősen gátolva a csontreszorpciót. A klinikai vizsgálatok bizonyítékai alapján, mind a vertebrális, mind a nem-vertebrális csonttöréseket csökkentő hatásuk miatt, első választandó szerként – megfelelő kalcium- és D-vitaminbevitel mellett – ajánlják az alendronátot, risedronátot és ibandronátot.
4.2.3. Az orális biszfoszfonátok kiváló klinikai hatása ellenére a betegek rövid- és hosszú távú együttműködési készsége is alacsonynak bizonyult, sokszor nem az előírás és az orvosi utasítás szerint szedik az orvosságot (rossz compliance), és elhagyják a krónikus betegségre rendelt, hosszú ideig szedendő gyógyszert (rossz perzisztencia).
4.2.4. Az együttműködést rontja a számos, gyógyszerbevétellel kapcsolatos kellemetlen előírás (a gyógyszert éhgyomorra, sima vízzel, álló, vagy egyenesen ülő helyzetben kell bevenni, utána egy ideig nem szabad lefeküdni, enni vagy inni), amely a felső gasztrointesztinális mellékhatások elkerülését és a megfelelő felszívódást biztosítja. Felmérések szerint az oszteoporózis kezelésének első évében a betegek mintegy fele, a harmadik év végére négyötöde nem megfelelően együttműködő. Az alacsony együttműködési készség nagyobb törésszámot eredményezett.
4.2.5. Társadalombiztosítási támogatással adhatók az orális biszfoszfonátok oszteoporotikus csonttörések primer prevenciója céljából azoknak az igazolt oszteoporózissal élő (BMD érték -2,5 SD T-score alatti), de oszteoporotikus csonttörést nem szenvedett posztmenopauzás nő vagy 55 év feletti férfi betegeknek, akiknek a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%). A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.6. A különböző hatóanyagok és kiszerelési formák közötti választás alapvetően a kezelőorvos egyéni mérlegelésének és szakmai döntésének tárgya, szem előtt tartva a terápia célját és a várható hatékonyságot, továbbá a terápia tolerálhatóságát; függ az adott beteg paramétereitől és az orvos tapasztalataitól. A készítmények alkalmazása során a maxillo-faciális régióban ritkán (1% alatt) csontnekrózis fordulhat elő, különösen egyes gyógyszerkölcsönhatások (pl. sztatin, szteroidok, egyes hormonkészítmények) miatt. Ezért a gyógyszerkészítmény alkalmazásának megkezdése előtt fogorvosi kivizsgálás és szükség szerinti kezelés elvégzése javasolt.
4.2.7. A költséghatékony kezelés követelményét szem előtt tartva törekedni kell az orális kezelésre, ugyanakkor figyelembe kell venni azokat a körülményeket (például nem megfelelően együttműködő beteg), melyek esetén a parenterális kezelés választása a célravezetőbb.
4.2.8. Az eddigi vizsgálatok szerint a parenterális biszfoszfonátok közül mind a zoledronát (5 mg/év) mind a ibandronát (3 mg/negyedév) hatékony a csontsűrűség javításában és a törési kockázat csökkentésében.
4.2.9. Társadalombiztosítási támogatással adhatók a parenterális biszfoszfonátok oszteoporotikus csonttörések primer prevenciója céljából azoknak az igazolt oszteoporózissal élő (BMD érték -2,5 SD T-score alatti), de oszteoporotikus csonttörést nem szenvedett posztmenopauzás nő vagy 55 év feletti férfi betegeknek, akiknek a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), de az orális biszfoszfonát kezelés ellenjavallt vagy dokumentált intolerancia vagy a kezelést hátrányosan befolyásoló egyéb tényező miatt nem folytatható. A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.10. A biszfoszfonátok alkalmazásánál különösen fontos a megfelelő kalcium és D-vitamin szint fenntartása, a másodlagos PTH-emelkedés kivédésére, illetve a megfelelő hatásosság biztosítására.
4.3. Stroncium ranel át
4.3.1. A stroncium ranelát csökkenti a csontreszorpciót és egyben serkenti a csontképződést, a klinikai vizsgálatok szerint mind a csigolyatörések, mind a csípőtáji törések kockázatát csökkenti.
4.3.2. A stroncium ranelát használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés primer prevenciójában, társadalombiztosítási támogatással alkalmazható azoknál a posztmenopauzás nő vagy 55 év feletti férfi betegeknél, akiknek az oszteoporózisa igazolt (BMD értéke -2,5 SD T-score alatti), és FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve oszteoporotikus csonttörés történt).
4.4. Denoszumab
4.4.1. A denoszumab monoklonális RANKL ellen ható antitest, a csontreszorpciót a RANK ligand gátlás útján célzottan csökkenti, hat a csontlebontás folyamatára, jelentősen növeli a csontdenzitást, és csökkenti mind a vertebrális, mind a nem-vertebrális csonttörések kockázatát. A denoszumab a csont trabekuláris és kortikális állományát is erősíti. A denoszumab terpápiás költsége miatt a finanszírozási rendben jelenleg a stroncium raneláttal esik egy kategóriába.
4.4.2. A denoszumab használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés primer prevenciójában, társadalombiztosítási támogatással alkalmazható azoknál a posztmenopauzás nő vagy 55 év feletti férfi betegeknél, akiknek az oszteoporózisa igazolt (BMD értéke –2,5 SD T-score alatti), és FRAX alapján számított 10 éves törési kockázata magas (általános >20%, illetve csípő >3%), ha a biszfoszfonát kezelés ellenjavallt vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve oszteoporotikus csonttörés történt).
4.4.3. A raloxifen és teriparatid oszteoporotikus csonttörés primer prevenciójában való alkalmazását a társadalombiztosítás nem támogatja.
4.5. Gyógyszer intolerancia meghatározása
4.5.1. A társadalombiztosítási támogatás szempontjából bármely orális biszfoszfonáttal szembeni intolerancia alatt értjük az olyan, megfelelő kezeléssel nem kontrollálható, folyamatosan fennálló, felső gasztrointesztinális traktust érintő zavarokat (gyulladás, fekély), melyek miatt az alkalmazási leirat szerinti szabályos kezelés kivitelezése vagy a terápia folytatása meghiúsulhat. A gasztrointesztinális mellékhatások az orális biszfoszfonátok jellemzői. Akiknél a nyelőcső rendellenességei vagy egyéb olyan állapotok állnak fenn, melyek a nyelőcső kiürülését késleltetik (pl. srtictura vagy achalasia), továbbá, ha a beteg képtelen arra, hogy legalább 30 percig álljon, vagy üljön, azoknál a betegeknél az orális biszfoszfonátokkal való kezelés kontraindikált, helyette parenterális biszfoszfonáttal vagy stroncium raneláttal ajánlott a kezelést végezni.
4.5.2. Az orális biszfoszfonátok alkalmazása viszonylag összetett. Nagy pohár (1-2 dl) vízzel kell bevenni, éhgyomorra, függőleges testhelyzetben, ezt követően még minimum 30 percig függőleges testhelyzetben kell maradni, ételt, folyadékot, más gyógyszert, vitamint, stb. ezen idő alatt nem fogyaszthat a beteg. Az orális ibandronátot havonta egyszer kell a betegnek bevennie, míg az alendronát és rizedronát alkalmazása esetén heti egyszeri alkalmazás szükséges. Az orális biszfoszfonátok alkalmazása kapcsán levonható a következtetés, hogy az esetek többségében a nyelőcső gyulladás kivédése az alkalmazási leirat pontos betartásával lehetséges. A beteg terápiában való együttműködése nem csupán az esetlegesen fellépő gyógyszer-mellékhatások függvénye, hanem kiemelt jelentőséggel bír a kezelőorvos részéről a beteg megfelelő tájékoztatása és felkészítése, hogy a kezelés megfelelően kivitelezett és eredményes legyen.
4.6. A kezelés időtartama
4.6.1. A modern terápiás irányelvek szerint elsősorban a magas kockázatú betegek gyógyszeres kezelése preferált, bizonyítottan törésmegelőző szerekkel. További alapelv, hogy a kezelést monoterápiában szükséges adni, a szükséges kalcium és D-vitaminpótlással. Egyéb gyógyszerkombinációtól nem várható további denzitásnövelés, de a mellékhatások előfordulása gyakoribbá válhat. A kezelés időtartamára vonatkozóan nincs még tudományosan kellően megalapozott, egységes álláspont. A gyógyszeres kezeléstől alapvetően azt várjuk, hogy a csontvesztés üteme lassuljon, megálljon, és ezáltal a csonttörés kockázata csökkenjen.
4.6.2. Az optimális kezelési eredmény az, ha a terápia első 2-3 évében a trabekuláris csontdenzitás 7-10%-kal nő, mert ez a törési rizikót felére csökkenti.
4.6.3. Vizsgálatok szerint már 12 hónapos kezelés statisztikailag szignifikáns javulást eredményez a betegek állapotában, ezért ennél rövidebb kezelési időszak alatt a terápia hatásosságát megítélni nem lehet.
4.6.4. A betegek állapotának kontrollálásában (oszteodenzitometria, labor-, röntgenvizsgálat, kockázat újraértékelés, stb.) a szakmai irányelvek szerint kell eljárni.
4.6.5. Biszfoszfonát kezeléseknél figyelembe kell venni, hogy a biszfoszfonátok lassan távoznak a csontszövetből, azaz hatásuk tartósan megmarad, ezért a megtartott-növekvő denzitás mellett, csonttörések hiányában három év után a terápia szüneteltetését, illetve öt év után a befejezését mérlegelni kell. A csípőtörések gyakorisága tíz év alatt nem nőtt azoknál a betegeknél, akik öt év után nem kaptak biszfoszfonátot azokhoz képest, akik végig szedték a vizsgált időszakban a gyógyszert.
4.7. Hatástalanság
4.7.1. A szakmai ajánlások alapján akkor mondhatjuk ki a kezelés hatástalanságát, ha minimum 12 hónapos kezelés ellenére a kontrollvizsgálat során 5%-os denzitáscsökkenést mérünk, illetve a kezelés ellenére oszteoporotikus csonttörés történik.
5. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
5.1. Az algoritmus posztmenopauzás nők és 55 év feletti férfiak oszteoporotikus csonttörését megelőző kezelésének sémáját mutatja be.
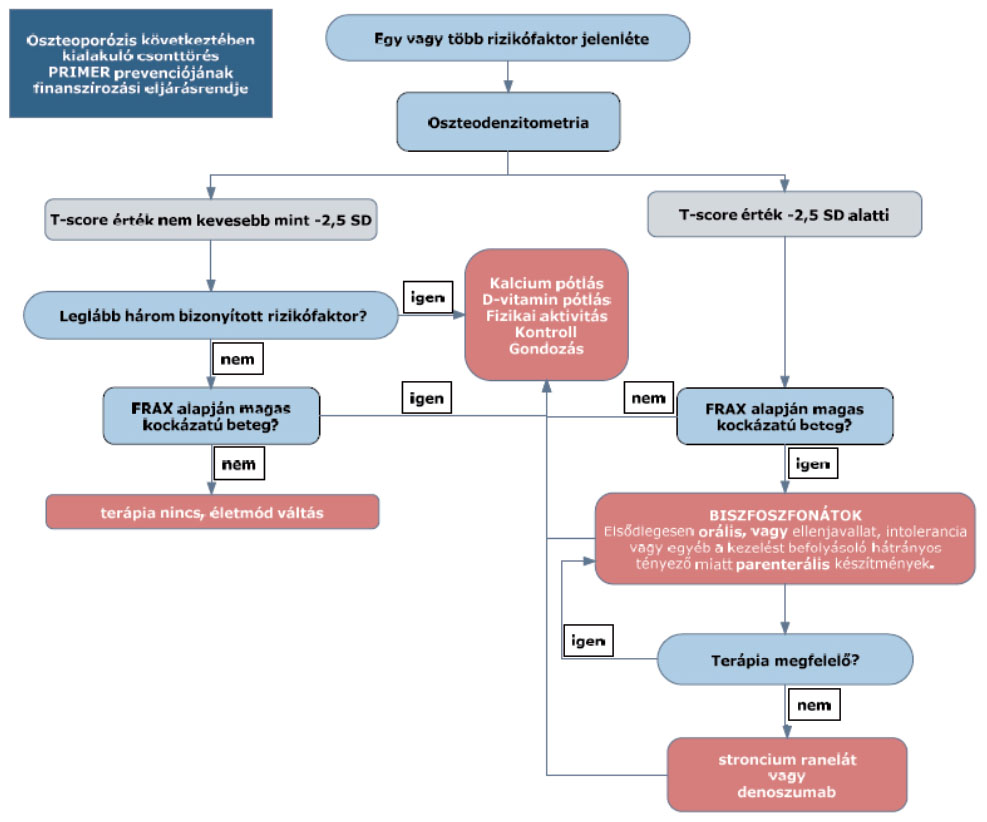
6. Az oszteoporózis prevenciós terápia finanszírozási és ellenőrzési kritériumai
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
A finanszírozó informatikai úton, folyamatba épített ellenőrzésként vizsgálja az elszámolásokat, hogy az alkalmazott diagnosztika és terápia az eljárásrenddel összhangban van-e.
A 4. § (3) bekezdése az 59/2015. (XII. 30.) EMMI rendelet 3. §-ával megállapított szöveg.
A 4. § (4) bekezdése az 59/2015. (XII. 30.) EMMI rendelet 3. §-ával megállapított szöveg.
Az 5. § az 59/2015. (XII. 30.) EMMI rendelet 4. §-ával megállapított szöveg.
Az 5. § (16) bekezdését a 15/2016. (VII. 15.) EMMI rendelet 5. §-a hatályon kívül helyezte.
A 6. § (2) bekezdését a 13. § (1) bekezdése hatályon kívül helyezte.
A 7–12. §-t a 13. § (1) bekezdése hatályon kívül helyezte.
A 7–12. §-t a 13. § (1) bekezdése hatályon kívül helyezte.
A 7–12. §-t a 13. § (1) bekezdése hatályon kívül helyezte.
A 7–12. §-t a 13. § (1) bekezdése hatályon kívül helyezte.
A 7–12. §-t a 13. § (1) bekezdése hatályon kívül helyezte.
A 7–12. §-t a 13. § (1) bekezdése hatályon kívül helyezte.
A 13. § a (2) bekezdése alapján hatályát vesztette.
Az 1. melléklet a 41/2016. (XII. 22.) EMMI rendelet 2. § (1) bekezdésével megállapított szöveg.
A 2. melléklet a 7/2014. (I. 29.) EMMI rendelet 11. § (2) bekezdésével megállapított, a 36/2019. (XII. 30.) EMMI rendelet 3. § (1) bekezdése szerint módosított szöveg.
A 3. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (1) bekezdésével megállapított szöveg.
A 4. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (2) bekezdésével megállapított, a 41/2016. (XII. 22.) EMMI rendelet 2. § (2) bekezdése szerint módosított szöveg.
Az 5. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (3) bekezdésével megállapított, a 9/2017. (V. 31.) EMMI rendelet 6. § (1) bekezdése, a 36/2019. (XII. 30.) EMMI rendelet 3. § (2) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (1) bekezdése szerint módosított szöveg.
A 6. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (4) bekezdésével megállapított, a 15/2016. (VII. 15.) EMMI rendelet 4. § (1) bekezdése szerint módosított szöveg.
A 7. melléklet a 35/2018. (X. 12.) EMMI rendelet 3. § (1) bekezdésével megállapított szöveg.
A 8. melléklet a 35/2018. (X. 12.) EMMI rendelet 3. § (2) bekezdésével megállapított szöveg.
A 9. melléklet a 35/2018. (X. 12.) EMMI rendelet 3. § (3) bekezdésével megállapított, az 55/2021. (XII. 22.) EMMI rendelet 4. § (2) bekezdése szerint módosított szöveg.
A 10. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (8) bekezdésével megállapított, a 35/2018. (X. 12.) EMMI rendelet 3. § (4) bekezdése, a 36/2019. (XII. 30.) EMMI rendelet 3. § (3) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (3) bekezdése szerint módosított szöveg.
A 11. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (9) bekezdésével megállapított, a 35/2018. (X. 12.) EMMI rendelet 3. § (5) bekezdése, a 36/2019. (XII. 30.) EMMI rendelet 3. § (4) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (4) bekezdése szerint módosított szöveg.
A 12. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (10) bekezdésével megállapított szöveg.
A 13. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (11) bekezdésével megállapított, a 35/2018. (X. 12.) EMMI rendelet 3. § (6) bekezdése szerint módosított szöveg.
A 14. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (12) bekezdésével megállapított, a 36/2019. (XII. 30.) EMMI rendelet 3. § (5) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (5) bekezdése, a 34/2022. (IX. 28.) BM rendelet 4. § (1) bekezdése szerint módosított szöveg.
A 15. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (13) bekezdésével megállapított, a 15/2016. (VII. 15.) EMMI rendelet 4. § (2) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § a) pontja, a 9/2017. (V. 31.) EMMI rendelet 6. § (2) bekezdése szerint módosított szöveg.
A 16. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (14) bekezdésével megállapított, a 15/2016. (VII. 15.) EMMI rendelet 4. § (3) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § b) pontja szerint módosított szöveg.
A 17. melléklet a 35/2018. (X. 12.) EMMI rendelet 3. § (7) bekezdésével megállapított, a 36/2019. (XII. 30.) EMMI rendelet 3. § (6) bekezdése szerint módosított szöveg.
A 18. melléklet az 59/2015. (XII. 30.) EMMI rendelet 5. § (15) bekezdésével megállapított, a 15/2018. (VI. 28.) EMMI rendelet 5. §-a szerint módosított szöveg.
A 19. melléklet a 32/2016. (X. 27.) EMMI rendelet 4. § (1) bekezdésével megállapított, a 35/2018. (X. 12.) EMMI rendelet 3. § (8) bekezdése, a 36/2019. (XII. 30.) EMMI rendelet 3. § (7) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (6) bekezdése szerint módosított szöveg.
A 20. mellékletet a 13. § (1) bekezdése hatályon kívül helyezte, újonnan az 59/2015. (XII. 30.) EMMI rendelet 5. § (16) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (4) bekezdése, a 9/2017. (V. 31.) EMMI rendelet 6. § (4) bekezdése szerint módosított szöveg.
A 21. mellékletet a 13. § (1) bekezdése hatályon kívül helyezte, újonnan az 59/2015. (XII. 30.) EMMI rendelet 5. § (17) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (5) bekezdése, a 9/2017. (V. 31.) EMMI rendelet 6. § (5) bekezdése szerint módosított szöveg.
A 22. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (18) bekezdése iktatta be.
A 23. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (19) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (6) bekezdése szerint módosított szöveg.
A 24. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (20) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (7) bekezdése, a 35/2018. (X. 12.) EMMI rendelet 3. § (9) bekezdése szerint módosított szöveg.
A 25. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (21) bekezdése iktatta be.
A 26. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (22) bekezdése iktatta be.
A 27. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (23) bekezdése iktatta be.
A 28. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (24) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (8) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja szerint módosított szöveg.
A 29. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (25) bekezdése iktatta be, szövege a 32/2016. (X. 27.) EMMI rendelet 4. § (2) bekezdése, a 35/2018. (X. 12.) EMMI rendelet 3. § (10) bekezdése, a 36/2019. (XII. 30.) EMMI rendelet 3. § (29) bekezdése, a 22/2020. (VI. 26.) EMMI rendelet 4. §-a szerint módosított szöveg.
A 30. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (26) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (9) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja, a 35/2018. (X. 12.) EMMI rendelet 3. § (11) bekezdése, a 34/2022. (IX. 28.) BM rendelet 4. § (2) bekezdése szerint módosított szöveg.
A 31. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (27) bekezdése iktatta be, szövege az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja, a 35/2018. (X. 12.) EMMI rendelet 3. § (12) bekezdése, a 36/2019. (XII. 30.) EMMI rendelet 3. § (9) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (7) bekezdése szerint módosított szöveg.
A 32. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (28) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (10) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja szerint módosított szöveg.
A 33. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (29) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (11) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja szerint módosított szöveg.
A 34. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (30) bekezdése iktatta be, hatályon kívül helyezte a 15/2016. (VII. 15.) EMMI rendelet 5. §-a.
A 35. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (31) bekezdése iktatta be, szövege az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja szerint módosított szöveg.
A 36. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (32) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (12) bekezdése, az 54/2016. (XII. 30.) EMMI rendelet 75. § d) és e) pontja szerint módosított szöveg.
A 37. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (33) bekezdése iktatta be, szövege a 35/2018. (X. 12.) EMMI rendelet 3. § (13) bekezdésével megállapított, a 36/2019. (XII. 30.) EMMI rendelet 3. § (10) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (8) bekezdése, a 34/2022. (IX. 28.) BM rendelet 4. § (3) bekezdése szerint módosított szöveg.
A 38. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (34) bekezdése iktatta be, szövege az 55/2021. (XII. 22.) EMMI rendelet 4. § (9) bekezdése szerint módosított szöveg.
A 39. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (35) bekezdése iktatta be, szövege a 35/2018. (X. 12.) EMMI rendelet 3. § (14) bekezdése szerint módosított szöveg.
A 40. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (36) bekezdése iktatta be, szövege a 32/2016. (X. 27.) EMMI rendelet 4. § (3) bekezdése, a 35/2018. (X. 12.) EMMI rendelet 3. § (15) bekezdése, az 55/2021. (XII. 22.) EMMI rendelet 4. § (10) bekezdése szerint módosított szöveg.
A 41. mellékletet az 59/2015. (XII. 30.) EMMI rendelet 5. § (37) bekezdése iktatta be, szövege a 15/2016. (VII. 15.) EMMI rendelet 4. § (13) bekezdése szerint módosított szöveg.
- Hatályos
- Már nem hatályos
- Még nem hatályos
- Módosulni fog
- Időállapotok
- Adott napon hatályos
- Közlönyállapot
- Indokolás



