38/2015. (VIII. 17.) EMMI rendelet
a törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet és a finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosításáról1
2015.11.01.
1. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosítása
7. § (1) Ez a rendelet – a (2) és (3) bekezdésben foglalt kivétellel – a kihirdetését követő napon lép hatályba.
(3) Az 5. § 2015. november 1-jén lép hatályba.
1–3. melléklet a 38/2015. (VIII. 17.) EMMI rendelethez6
4. melléklet a 38/2015. (VIII. 17.) EMMI rendelethez7
5. melléklet a 38/2015. (VIII. 17.) EMMI rendelethez
A hepatitis C vírus okozta krónikus májgyulladás diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Hepatitis C vírus által okozott idült májgyulladás B1820
a) Cirrhosis: az irányelv szempontjából ide értendők mindazok a betegek, akiknél szövettani vizsgálattal előrehaladott (bridging) fibrosis vagy definitív cirrhosis alakult ki (tehát Metavir és Knodell F3-F4, vagy Ishak F4-F5-F6), FibroScan vizsgálattal a máj stiffness 12 kPa feletti, vagy mindkét előbbi ellenjavallata/kivitelezhetetlensége/elérhetetlensége esetén más validált nem-invazív vizsgáló módszer (pl. FibroTest, ELF teszt) cirrhosisra utal.
b) Prioritási Index: a májfibrosis mértékén alapuló, a betegség aktivitását, a kezelés sikerességének várható esélyét és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-fertőzött betegek kezelésbe vonásának szakmailag indokolt sorrendjét meghatározó numerikus érték.
c) PR kettős kezelés: PegIFN+RBV kezelés.
d) PRP hármas kezelés: PegIFN+RBV+PI (boceprevir vagy szimeprevir/telaprevir) kezelés.
e) Bevezető (lead-in) kezelés: a PRP hármas kombinációs kezelés bevezetéseként alkalmazott PR kettős kezelés.
f) STOP-szabály: nem megfelelő vírusválasz miatti korai kezelés-befejezés.
g) Detekciós limit (DL): a HCV-RNS kimutathatóságának határértéke.
h) Nem detektálható HCV: a HCV-RNS 15 IU/ml-nél nem nagyobb detekciós határú Real-Time PCR módszerrel nem mutatható ki.
i) Negatív PCR: a nem detektálható HCV-RNS jelent PCR negativitást.
j) Naiv-nak minősülő beteg: a finanszírozási eljárásrend szempontjából naiv-nak minősülnek mindazok, akik soha nem részesültek kezelésben, akik csak nem-pegilált IFN±RBV kezelésben részesültek, és akik rövidebb, mint 12 hétig részesültek PegIFN+RBV kezelésben, akiknél a korábbi IFN±RBV kezelés nem STOP szabály miatt állt le.
k) Korábban sikertelenül kezelt beteg: a finanszírozási eljárásrend szempontjából mindazok, akik korábban legalább 12 hetes PR kettős vagy PRP hármas kezelés során nem váltak PCR negatívvá vagy vírusáttörés, illetve relapszus volt tapasztalható.
l) Korábbi PR kettős kezelésre null-reagáló beteg: a korábbi PR kezelés során a HCV-RNS szint csökkenése 4 hét elteltével nem éri el az 1 log10 mértéket (nem csökken legalább 1/10-ed részére), 12 hét elteltével nem érte el a 2 log10 nagyságrendet (nem csökken legalább 1/100-ad részére).
m) Korábbi PR kettős kezelésre részlegesen reagáló beteg: a korábbi PR kezelés során a HCV-RNS szint 12 hét elteltével legalább 2 log10 mértékben csökkent, de a kezelés alatt mindvégig detektálható maradt.
n) Korábbi PR kettős kezelés alatt vírusáttörést mutató beteg: a korábbi PR kezelés alatt nem detektálható HCV-RNS később a kezelés során ismét kimutathatóvá vált.
o) Korábbi PR kettős kezelés után relabáló beteg: a korábbi PR kezelés befejezésekor a HCV-RNS nem detektálható, de a kezelés befejezése után ismét kimutatható.
p) Kiterjesztett rapid vírusválasz PRP hármas kezelés során (eRVR): a kezelés megkezdését követően a HCV-RNS a 4. és a 12. héten sem detektálható.
q) Tartós vírusválasz (SVR): a kezelés befejezését követően 24 héttel a HCV-RNS nem mutatható ki.
A hepatitis C vírus (HCV) okozta májgyulladás a transzfúziós hepatitisek leggyakoribb oka volt. A világban kb. 170 millióra becsülik a hepatitis C vírussal fertőzöttek számát, mely jelentős pandémiát jelent, mivel ez az össznépesség kb. 3%-a, és ez ötször nagyobb arányt jelent, mint a HIV1 vírus elterjedtsége. A véradók szűrése (1992 óta) jelentősen csökkentette az infekció átvitelének gyakoriságát a korábbi 17%-ról a jelenlegi 0,001%-ra, de az új esetek megjelenése folyamatos, elsősorban az intravénásan alkalmazott kábítószerek elterjedtsége, valamint az egyéb parenterális átviteli lehetőségek miatt. A krónikus hepatitis C vírus fertőzés a leggyakoribb indikációja a májátültetéseknek. Magyarországon az első felmérések 1,3%-os incidenciát mutattak, a 2000–2004-es adatok 0,6–0,8%-os szeropozitivitást mutattak. A szeropozitív személyek 60–90%-ában kimutatható a HCV (PCR pozitívak). A hazai fertőzöttek több mint 95%-ánál 1. genotípus (főleg 1 b) mutatható ki.
Bizonyos fokozottan veszélyeztetett populációkban az előfordulás magas: politranszfundáltaknál (hemofiliások között) 50–80%, hemodializáltaknál 30–40%, intravénás droghasználók esetében 30–90% a HCV szeropozitívak aránya. A krónikus májbetegeknél, cirrhosisban és hepatocellularis carcinomában szenvedőknél a HCV antitest pozitivitás igen magas, 20–90%.
A fertőzés forrása a viraemiás beteg vagy hordozó. Az intravénás kábítószert használók közös tű- és fecskendő használata eredményezi az érintettek magas HCV-prevalenciáját. A fertőzés eredete a betegek 20–50%-ában nem deríthető ki. HCV pozitivitást jelezhet a cryoglobulinaemia is. A HCV pozitív személyek többsége a 45–65 éves korosztályban található.
2.1. Rizikócsoportot képeznek továbbá
2.1.1. az egészségügyi dolgozók,
2.1.2. a tetováltak, piercinget viselők,
2.1.3. egyes bőrbetegségekben szenvedők (például porphyria cutanea tarda),
2.1.5. az 1993 előtt szervátültetésben részesültek,
2.1.6. a vérkészítményben részesülők,
2.1.7. a fertőzöttek szexuális partnerei és
2.1.8. a hemodializáltak.
A betegség nagymértékben hozzájárul a rokkantság és halálozás növekedéséhez. Az esetek többségét nem fedezik fel, és leginkább alkoholos vagy gyógyszeres-kémiai májkárosodásnak, illetve zsírmájnak vélik.
A betegség diagnózisának felállításában az anamnézis felvétel és a fizikális vizsgálat mellett nagy szerepe van a laboratóriumi diagnosztikának. Az alapellátás feladata a májbetegség felismerése és a HCV ellenanyag-szint vizsgálata. Szűrővizsgálatra az anti-HCV harmadik generációs EIA, ELISA teszt javasolt. Utóbbi elvégzése májkárosodás észlelésekor vagy rizikócsoportokban szükséges. Minden személyt szűrni kell, akinél magas a HCV fertőzés rizikója. A betegek szakellátása hepatológiai centrumokban összpontosul.
3.1. A diagnózis pillérei
3.1.1. pozitív vírus-szerológia (anti-HCV ellenanyag),
3.1.2. a virális nukleinsav (HCV-RNS) detektálhatósága, valamint
3.1.3. a májkárosodás kimutatása kóros transzaminázok (GPT/ALT) és/vagy májbiopszia és/vagy tranziens elasztográfia (FibroScan vizsgálat) és/vagy ezen utóbbi két eljárás ellenjavallata/kivitelezhetetlensége/elérhetetlensége esetén más validált nem-invazív vizsgáló módszer (pl. FibroTest, ELF tesz) alapján.
Ellenjavallatok hiányában kimutatható HCV-RNS és biokémiai, szövettani vagy nem-invazív módszerrel igazolható aktivitás és/vagy fibrosis esetén kezelés javasolt.
3.2. A diagnosztikus tesztek
vizsgálatok csoportjába sorolhatók.
Az utóbbi a vírus nukleinsav kimutatását jelenti. Meg kell határozni a vírus nukleinsav titerét és a genotípusát, ami a terápia megtervezésében alapvető fontosságú. A terápia célja a vírus teljes kiirtása a szervezetből. A terápia hatékonysága elsősorban a vírus genotípusától függ.
3.3. Gyógyszeres kezelés indokolt, amennyiben
3.3.1. a HCV-RNS kimutatható, és
3.3.2. a GPT emelkedett vagy a májbiopszia vírusos infekcióra jellemző gyulladást és necrosist mutat és/vagy a transiens elastographia (FibroScan) fibrosist mutat.
A krónikus C-hepatitis spontán remissziója és gyógyulása gyakorlatilag nem fordul elő. A betegek jelentős részénél a krónikus gyulladást (annak aktivitásától függetlenül) fibrosis kíséri. Ennek gyorsasága és mértéke nagy egyéni különbségeket mutat, de ez szabja meg a beteg sorsát. A cirrhosis kialakulása átlag 20–25 év alatt következik be, majd a cirrhosis kialakulása után a betegekben HCC jelentkezik évente 3–5%-os gyakorisággal.
A progressziót gyorsítja a rendszeres alkoholfogyasztás, a haemochromatosis, a társfertőzés egyéb hepatitisvírussal. Az alkoholos cirrhosis HCV fertőzésben az alkohol elhagyása után is progrediálhat. Kompenzált HCV-cirrhosis hirtelen fulmináns dekompenzációját okozhatja akut HAV fertőzés. HIV pozitív betegben az AIDS lefolyását a krónikus C-hepatitis enyhe formája is gyorsítja, valamint HIV fertőzés mellett a hepatitis progressziója is gyorsabb. A progresszió gyorsabb túlsúlyos betegekben (27 feletti testtömeg-index). Szervtranszplantált betegeknél az akut szakasz súlyosabb, majdnem mindig krónikussá válik, és a progresszió rapid. A prognózis összefüggése a HCV vírustiter nagyságával még nem kellően bizonyított.
4. Interferon alapú terápia
4.1. Alapvető megfontolások
4.1.1. A kezelések szakmai felügyeletét és jóváhagyását a szakmai szervezetek által delegált Hepatitis Terápiás Bizottság végzi. Összetételét, működését külön dokumentum szabályozza.
4.1.2. 2013. január 1-jétől kezelési engedély csak az erre a célra létrehozott Hepatitis Regiszter (HepReg) rendszerben elektronikusan benyújtott kérelmek alapján adható ki.
4.1.3. A kezelésre jogosultak között szakmai konszenzus alapján a kezelés sorrendjét elsősorban a májfibrosis előrehaladottsága határozza meg, de a sorrendet a betegség aktivitása, a kezelés sikerének várható esélye és további meghatározott speciális szempontok is befolyásolják.
4.1.4. A betegek gyógyszeres terápiájának megkezdése minden esetben (független attól, hogy korábban részesült-e már kezelésben vagy sem) a Hepatitis Terápiás Bizottság által meghatározott Prioritási Index alapján történik.
4.1.5. Valamennyi naiv-nak minősülő, kezelésben korábban nem részesült beteg kezelését PR kettős kombinációval kell megkezdeni, amennyiben nincs ellenjavallat.
4.1.6. Az interferon-alapú kezelések alatti víruskinetika protokoll szerinti követése, és a STOP-szabályok maradéktalan betartása kiemelt fontosságú!
4.1.7. A korábban PR kettős kezelésben részesült, de a STOP-szabály miatt a kezelésből kieső betegek várólistára kerülnek, és további kombinációs kezelésbe történő bevonásuk a Prioritási Index alapján kialakult várólista sorrend szerint történik, amelyre a Hepatitis Terápiás Bizottság ad engedélyt.
4.1.8. A kezelés során laboratóriumi monitorozás szükséges: bármely új gyógyszer bevezetését követően az első 4 hétben kéthetente, majd négyhetenként teljes vérkép, GPT/ALT, GOT/AST, se. bilirubin, 12 hetenként se. kreatinin, vércukor, TSH meghatározása.
4.1.9. Tartós vírusválasz (SVR) megítélésére a HCV-RNS negatívvá vált betegeknél a kezelés befejezése után 24 héttel HCV-RNS vizsgálat szükséges.
4.1.10. Bármely STOP-szabály hatálya alá eső beteg számára csak a korábbinál igazoltan hatékonyabb gyógyszeres kezelés vagy természetes IFN rendelhető.
4.1.11. A kezelés előtt vagy alatt hepatitis A és hepatitis B ellen vakcináció javasolt.
4.2. Prioritási Index definíciója, célja
4.2.1. A Prioritási Index a májfibrosis mértékén alapuló, a betegség aktivitását, a kezelés sikerességének várható esélyét, és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-s betegek kezelésbe vonásának szakmailag indokolt sorrendjét meghatározó numerikus érték, amelynek célja, hogy orientálja a kezelőorvosokat a kezelésre szorulók ütemezését illetően, mind a kérvények benyújtásakor, mind pedig az engedélyezett kezelések megkezdésekor.
4.2.2. Objektív komponensei:
4.2.2.1. a májbetegség stádiuma,
4.2.2.2. a májbetegség aktivitása,
4.2.2.3. a májbetegség progressziójának üteme,
4.2.2.4. a terápia várható eredményességét befolyásoló prognosztikus faktorok.
4.2.3. Szubjektív komponensei:
4.2.3.1. a kezelőorvos megítélése szerinti prioritási pontok,
4.2.3.2. a Hepatitis Terápiás Bizottság által adható prioritási pontok.
4.2.4. Speciális szempontok:
4.2.4.1. Szervtranszplantált/transzplantációra váró betegek,
4.2.4.2. hemophiliás/vérzékeny betegek kezelési prioritását reprezentáló pontok (ekkor csak eredménytelen/elérhetetlen nem-invazív vizsgáló módszer esetén adható),
4.2.4.3. Foglalkozással, foglakoztathatósággal, gyermekvállalással és egyéb speciális szemponttal összefüggő pontok
4.2.4.4. a Hepatitis Terápiás Bizottság által indoklással megadható egyéb speciális esetekben megítélhető pontok.
A Prioritási Index a kezelésre várakozás alatt 2 havonta 1 ponttal növekszik.
4.2.5. Prioritási Index számítása
A Prioritási Index az alábbi pontok alatt felsorolt paraméterekhez tartozó pontszámok numerikus összege:
4.2.5.1. Stádium szövettan, FibroScan vagy más non-inazív teszt alapján (maximum 85 pont)
4.2.5.1.1. A májbiopsziát (szövettant) FibroScan helyettesítheti, vagy mindkettő ellenjavallata/kivitelezhetetlensége/elérhetetlensége esetén más validált nem-invazív vizsgáló módszer (pl. FibroTest, ELF teszt) helyettesítheti
4.2.5.1.2. Metavir/Knodell/FibroScan/FibroTest/ELF teszt F0–F4 szerint 0–4x10 pont (maximum 40 pont)
4.2.5.1.2.1. Átmenetek: F0/F1, F1/F2, F2/F3, F3/F4 esetén sorrendben 5–15–25–35 pont
4.2.5.1.2.2. Ishak fibrosis score értékelése: 1: 10 pont, 2: 15 pont, 3: 20 pont, 4: 30 pont, 5: 35 pont, 6: 40 pont
4.2.5.1.2.3. Plusz pontok előrehaladott cirrhosis miatt liver stiffness alapján (maximum 35 pont)
4.2.5.1.2.4. 18,0–32,9 kPa között 5 kPa-onként +5 pont
4.2.5.1.2.5. 33,0 kPa felett 10 kPa-onként +5 pont
4.2.5.1.3. Ha egyik vizsgálat eredménye sem áll rendelkezésre, akkor 10 pont
4.2.5.2. Aktivitás, progresszió üteme (maximum 8 pont)
4.2.5.2.1. Az alábbiak közül a nagyobbik (maximum 4 pont)
4.2.5.2.1.1. HAI vagy Ishak aktivitás: 3–6 = 1 pont, 7–9 = 2 pont, 10–12 = 3 pont, 13-tól = 4 pont
4.2.5.2.1.2. METAVIR aktivitás: A1 = 1 pont, A2 = 2 pont, A3 = 3 pont, A4 = 4 pont
4.2.5.2.1.3. Progresszió FibroScan-el: Δ 1–1,99 kPa = 1 pont, Δ 2–2,99 kPa = 2 pont, Δ3 kPa = 4 pont
4.2.5.2.1.4. Progresszió szövettannal (Δ F stádium) ΔF1 = 1, ΔF2 = 2, ΔF3 = 3, ΔF4 = 4
4.2.5.2.2. Utolsó GPT (NE/ml) érték/50 = pontszám (maximum 4 pont)
4.2.5.3. Gyógyhajlam, prediktorok (maximum 10 pont)
4.2.5.3.1. Életkor 40 év alatt: 1 pont
4.2.5.3.2. HCV G1b genotípus: 1 pont
4.2.5.3.3. HCV G2 genotípus: 8 pont
4.2.5.3.4. HCV G3 genotípus: 6 pont
4.2.5.3.5. Kiinduló vírustiter < 400.000 = 2 pont, 400.000–2.000.000 = 1 pont
4.2.5.3.6. Aktuálisan kettős kezelésre nem reagáló, naivnak minősülő beteg: 3 pont
4.2.5.3.7. Relabáló beteg: 4 pont
4.2.5.3.8. Parciális responder beteg: 1 pont
4.2.5.3.9. Thrombocytaszám: 150 G/l felett = 2 pont, 100–150 G/I = 1 pont
4.2.5.4. Automatikusan nem értékelhető egyéb szempontok (maximum 6 pont)
4.2.5.4.1. Kezelőorvos pontja: maximum 2 pont (indoklás szükséges)
4.2.5.4.2. Hepatitis Terápiás Bizottság pontja: maximum 4 pont (indoklás szükséges)
4.2.5.5. Speciális pontok
4.2.5.5.1. PegIFN+RBV kezelés: 20 pont (visszavonandó DAA adása esetén)
4.2.5.5.2. DAA hármas kezelésre történő folytatólagos áttérés miatt adható plusz pontok a vírusválasz szerint:
4.2.5.5.2.1. HCV-RNS csökkenés a kettős kezelés 12. hetében 1–2 log10: 4 pont
4.2.5.5.2.2. HCV-RNS csökkenés a kettős kezelés 12. hetében > 2 log10: 10 pont
4.2.5.5.3. Dokumentáltan 6 hónapnál nem régebben akvirált HCV fertőzés: 50 pont
4.2.5.5.4. Transzplantáció miatti plusz pontok (bármely szerv transzplantációja esetén):
4.2.5.5.4.1. Transzplantációs listán lévő beteg: 10 pont
4.2.5.5.4.2. Élő donoros transzplantációra váró beteg: 20 pont
4.2.5.5.4.3. Transzplantáción átesett beteg: 30 pont
4.2.5.5.4.4. Transzplantáción átesett betegben F3–4 stádium és/vagy fibrotizáló cholestaticus hepatitis: 60 pont
4.2.5.5.5. Haemophíliás beteg, ha fibroscan nem érhető el: 20 pont
4.2.5.5.6. Haemodializált beteg: 20 pont
4.2.5.5.7. Különleges egyéb epidemiológiai indok (indoklással, pl. intézeti elhelyezés): 10 pont
4.2.5.5.8. In vitro fertilitási programban résztvevő beteg: 20 pont
4.2.5.5.9. HCV eradikálása után gyermeket vállalni szándékozó 30 év feletti gyermektelen nőbeteg: 20 pont (a kezelésre szoruló nyilatkozatát csatolni szükséges)
4.2.5.5.10. Súlyos extrahepatikus HCV manifestatio (pl. cryoglobulinaemias vasculitis): 20 pont
4.2.5.5.11. Egészségügyi dolgozó: 20 pont
4.2.5.5.12. HCV fertőzöttség miatt foglalkozása gyakorlásától jogszabályban eltiltott személy: +50 prioritási pont
4.2.5.5.13. HIV vagy HBV koinfectio: 20 pont
4.2.5.5.14. A Prioritási Index a kezelésre várakozás alatt (az ezirányú kérvény benyújtását követően kéthavonta 1 ponttal növekszik).
4.3. A betegség terápiájában használatos készítmények
4.3.1. Pegilált interferon + ribavirin kettős kezelés (PR)
4.3.1.1. Valamennyi HCV genotípus esetén a naiv-nak minősülő betegek kezelését PR kettős kombinációval kell megkezdeni (proteáz-gátló nélkül), amennyiben nincs ellenjavallat.
4.3.1.2. Teljes kezdő dózis: hetente 1x180 µg PegIFN-alfa-2a vagy hetente 1x1,5 µg/ttkg PegIFN-alfa-2b+ napi 600-1400 mg (>13,0 mg/ttkg) RBV.
4.3.1.3. Ribavirinnel kombinált heti 1x1,0 µg/ttkg kezdődózisú PegIFN-alfa-2b-vel végzett kezelés is hatékonynak bizonyult. Ilyen csökkentett kezdődózissal végezhető kezelés pl. kifejezett thrombopenia vagy leukopenia esetén (ld. speciális betegcsoportok).
4.3.1.4. A PegIFN és/vagy ribavirin mellékhatás miatti dóziscsökkentésre vonatkozó szabályokat a készítmények alkalmazási előírásai ismertetik. (Ribavirin esetében a mellékhatás miatti dóziscsökkentés 200 mg-os lépésekben javasolt.)
A két különböző PegIFN egymással történő helyettesíthetőségével kapcsolatban nem állnak rendelkezésre adatok, ezért nem ajánlott.
4.3.2. Pegilált interferon + ribavirin + proteáz-gátló (PI) hármas kezelés (PRP)
4.3.2.1. A proteáz-gátlók (PI) orálisan adható, a HCV G1 genotípus ellen direkt antivirális hatással rendelkező készítmények.
4.3.2.2. A PI készítmények kizárólag verifikált HCV G1 genotípussal fertőzött betegeknél, kizárólag PegIFN+RBV mellett, harmadik szerként alkalmazhatók az Országos Egészségbiztosítási Pénztár (a továbbiakban: OEP) általi finanszírozással a Prioritási Index alapján kialakult várólista sorrendnek megfelelően azon betegeknél, akiket
4.3.2.2.1. korábban pegilált interferonnal kezeltek ribavirinnel kombinálva és
4.3.2.2.2. a kezelésre nem reagáltak (null-reagálók) vagy visszaesők és
4.3.2.2.3. kompenzált májbetegségben szenvednek (beleértve a cirrhosist is)
a finanszírozási folyamatábrában részletezettek szerint.
4.3.2.3. PegIFN és/vagy RBV és/vagy PI ellenjavallata és/vagy intolerancia kialakulása esetén PRP hármas kezelés nem végezhető.
4.3.2.4. RBV nélküli PegIFN terápia kombinálása PI kezeléssel rezisztencia kialakulása miatt tilos.
4.3.2.5. PRP hármas kezeléskor a kétféle PegIFN készítmény (2a, illetve 2b) bármelyike alkalmazható, dózisuk és a ribavirin dózisa megfelel az előzőekben leírtaknak.
4.3.2.6. PRP hármas kezeléskor a háromféle PI készítmény (boceprevir, illetve szimeprevir/telaprevir) bármelyike alkalmazható, de az alkalmazás módja, ideje, a rendelkezésre álló evidenciák és a mellékhatások különbözősége befolyásolhatja az egyes betegeknél a PI választást:
4.3.2.6.1. boceprevir alapú hármas kezelés javasolható olyan betegeknél, akiknél nagy az esélye, hogy hatástalanság miatt a PRP hármas kezelést az első 12 héten belül be kell fejezni. Ilyen betegek lehetnek például a korábbi PR kezelés során null-reagáló cirrhosisos betegek,
4.3.2.6.2. korábbi PR kettős kezelés után relabáló nem-cirrhotikus betegek számára – a rövidebb kezelés lehetősége miatt – költséghatékonysági szempontból a szimeprevir/telaprevir látszik célszerűbbnek,
4.3.2.6.3. mellékhatás esetén a PI-ok dózisának csökkentése nem javasolt; a PegIFN vagy a ribavirin dózisának csökkentése és/vagy a PI teljes elhagyása, vagy mindhárom készítmény elhagyása mérlegelendő.
4.3.3. Gyógyszer-rezisztencia
Gyógyszer rezisztenciáról akkor beszélhetünk, ha a PI kezelés alatt a PI-ra nem reagáló HCV törzsek felszaporodása 10% feletti mértékben van. PI kezelés során gyógyszer-rezisztencia kialakulását jelzi, ha két kvantitatív HCV-RNS meghatározás közötti időszakban a HCV-RNS szint 1-log10 mértékben megnövekszik, vagy ha a korábban nem kimutatható HCV-RNS újból kimutathatóvá válik. A rezisztencia vizsgálatok csak kutatási jelleggel, nem az OEP által finanszírozott módon javasoltak. Gyógyszer-rezisztencia kialakulásakor minden esetben a kezelés megszakítása szükséges (STOP-szabály), keresztrezisztenciát mutató másik PI-val sem végezhető kezelés.
4.3.3.1. A proteáz-gátlók számos gyógyszerrel kölcsönhatásba lépnek (ld. alkalmazási előírás).
4.3.3.2. Sikertelen PRP hármas kezelés után ismételt interferon-alapú kezelés nem javasolható, kivétel, ha a sikertelenség valószínűsíthető oka nem a vírusválasz elmaradása, hanem a készítmény gyógyszer-specifikus mellékhatása.
4.3.4. Boceprevir (200 mg kapszula) specifikus alkalmazási szempontok
4.3.4.1. Lead-in periódus
A boceprevir alapú hármas kezelés minden esetben 4 hetes bevezető (lead-in) PR kettős kezeléssel kezdődik. A kezelési hetek számolása minden esetben a lead-in periódus kezdetétől indul.
Adagolás 7–9 órás intervallumokban, naponta háromszor 800 mg (3x4 kapsz.) per os, étkezés közben, alkalmazási előírás szerint.
4.3.4.3.1. anaemia, mely miatt a klinikai vizsgálatokban kezelt betegek 43%-ánál erythropoetin adására került sor, és a betegek 3%-ánál vált szükségessé transzfúzió (ld. alkalmazási előírás).
Az erythropoetin az off-label alkalmazás szabályai szerint adható, de a ribavirin adagjának csökkentése inkább javasolható. Ez történhet egy lépésben is 600 mg-ra.
4.3.5. A boceprevir alapú hármas kezelés virológiai követése, STOP-szabályok
4.3.5.1. A boceprevir alapú hármas kezelés során újrakezeléskor a lead-in kezelés kezdetétől számított 12. és 24. hét elteltével mennyiségi HCV-RNS vizsgálat szükséges.
4.3.5.2. STOP-szabályok: a boceprevir alapú kezelés abbahagyandó (mindegyik készítmény), ha
4.3.5.2.1. STOP-szabály: a HCV-RNS szint 8 hét kezelés után kimutatható vagy
4.3.5.2.2. STOP-szabály: a HCV-RNS szint 12 hét kezelés után kimutatható vagy
4.3.5.2.3. STOP-szabály: a HCV-RNS 24 hét kezelés után kimutatható.
4.3.6. Telaprevir (375 mg filmtabletta) specifikus alkalmazási szempontok
4.3.6.1. Telaprevir kezeléskor a kezelés kezdetétől mindhárom készítményt együtt kell alkalmazni.
4.3.6.2. Lead-in periódus alkalmazása nem szükséges (de hátrányt sem jelent).
4.3.6.3. A kezelési hetek számolása minden esetben a telaprevir kezelés megkezdésétől indul.
Adagolás 8 óránként 750 mg (3x2 tabl.) per os, zsírtartalmú étellel együtt (ld. alkalmazási előírás).
4.3.6.5.1. bőrkiütés, amely miatt a betegek 4–5%-ánál válhat szükségessé a telaprevir elhagyása,
4.3.6.5.2. anaemia, amely ugyanolyan módon kezelendő, mint boceprevir esetén.
4.3.7. A telaprevir alapú hármas kezelés virológiai követése, STOP-szabályok
4.3.7.1. A telaprevir alapú hármas kezelés során a kezelés megkezdése után 4, 12 és 24 héttel mennyiségi HCV-RNS vizsgálat szükséges.
4.3.7.2. STOP-szabályok: a telaprevir alapú kezelés abbahagyandó (mindegyik készítmény), ha
4.3.7.2.1. STOP-szabály: a HCV-RNS szint 4 hét kezelés után >1000 IU/ml, vagy
4.3.7.2.2. STOP-szabály: a HCV-RNS szint 12 hét kezelés után > 1000 IU/ml, vagy
4.3.7.2.3. STOP-szabály: a HCV-RNS 24 hét kezelés után is ≥ 15 IU/ml.
4.3.8. Szimeprevir specifikus alkalmazási szempontok
4.3.8.1. Szimeprevir kezeléskor a kezelés kezdetétől mindhárom készítményt együtt kell alkalmazni.
Adagolás: naponta egyszer 150 mg, 12 héten keresztül per os, étkezés közben bevéve (ld. alkalmazási előírás).
4.3.8.3.1. bőrkiütés, amely miatt a betegek 0,8%-ánál válhat szükségessé a szimeprevir elhagyása,
4.3.8.3.2. enyhe vagy közepesen súlyos fotoszenzitivitási reakciók,
4.3.8.3.3. emelkedett bilirubin szint, dyspnoe, ami még nem indokolta a kezelés abbahagyását.
4.3.9. A szimeprevir alapú hármas kezelés virológiai követése, STOP-szabályok
4.3.9.1. A szimeprevir alapú hármas kezelés során a kezelés megkezdése után 4, 12 és 24 héttel mennyiségi HCV-RNS vizsgálat szükséges.
4.3.9.2. STOP-szabályok: a szimeprevir alapú kezelés abbahagyandó (mindegyik készítmény), ha
4.3.9.2.1. STOP-szabály: a HCV-RNS szint 4 hét kezelés után ≥25 IU/ml, vagy
4.3.9.2.2. STOP-szabály: a HCV-RNS 12 hét kezelés után kimutatható (PCR pozitív), vagy
4.3.9.2.3. STOP-szabály: a HCV-RNS 24 hét kezelés után kimutatható (PCR pozitív).
4.3.10. Standard interferon + ribavirin kombináció
4.3.10.1. Standard interferon (StdIFN) kezelés kifejezett thrombopenia vagy leukopenia hajlam esetén végezhető, de ilyenkor is mérlegelendő csökkentett dózisú PegIFN+RBV terápia végzése. A StdIFN dózisa: heti 3x3–6 ME, mely – ha nem ellenjavallt – a fenti dózisú RBV-nel kombinálandó.
4.3.10.2. A PI kezeléssel történő kombinálásra nincsen adat, így nem ajánlott.
4.3.11. Pegilált interferon (PegIFN) vagy standard interferon (stdIFN) monoterápia
4.3.11.1. RBV ellenjavallata esetén a fenti dózisú PegIFN, vagy – ha az nem végezhető – StdIFN monoterápia végezhető.
4.3.11.2. RBV nélküli IFN/PegIFN terápia kombinálása PI kezeléssel rezisztencia kialakulása miatt tilos.
4.3.12. Természetes interferon
4.3.12.1. Az IFN/PegIFN+RBV+PI terápiából STOP-szabály miatt kiesett betegek liofilizált természetes human leukocita IFN-nal kezelhetők, az eredetileg tervezett időtartamig. Dózis: heti 3x3 ME. A kezelés a biokémiai remisszió fenntartása érdekében – engedélyezést követően – egy éven túl is folytatható, illetve biokémiai relapszus esetén ismételhető.
4.3.12.2. Extrahepaticus manifesztáció (pl. cryoglobulinaemiás vasculitis) esetén egy évig akkor is végezhető természetes IFN kezelés, ha a GPT/ALT érték és a szövettan alapján májérintettség nem bizonyítható. Indokolt esetben a kezelés egy év után meghosszabbítható.
4.3.12.3. Igazoltan IFN alfa-2 ellenes neutralizáló antitestek miatt nem reagáló vagy relabáló betegnél (beleértve a break through jelenséget is) az ilyen antitestek jelenléte esetén is igazoltan hatékony természetes IFN±RBV-nel teljes dózisú és időtartamú ismételt kezelés végezhető.
4.3.12.4. A PI kezeléssel történő kombinálásra nincsen adat, így nem ajánlott.
4.3.13. Pegilált interferon alfa + ribavirin + NS5B inhibitor (sofosbuvir) hármas kezelés
4.3.14. Sofosbuvir specifikus alkalmazási szempontok
4.3.14.1. Sofosbuvir kezeléskor a kezelés kezdetétől mindhárom készítményt együtt kell alkalmazni.
4.3.14.2. Kizárólag verifikált HCV G1 genotípussal fertőzött betegeknél adható OEP finanszírozással a Prioritási Index alapján kialakult várólista sorrendnek megfelelően.
Adagolás: naponta egyszer 400 mg, 12 héten keresztül per os, étkezés közben bevéve (ld. alkalmazási előírás).
4.3.14.4.1. vérkép: anémia, neutropénia, csökkent thrombocita és limfocitaszám, emelkedett bilirubinszint,
4.3.14.4.2. anyagcsere tünetek: csökkent étvágy, hányás, hányinger,
4.3.14.4.3. pszichiátriai és idegrendszeri tünetek: insomnia, szédülés, fejfájás.
4.3.15. Ha a sofosbuvirral kombinációban alkalmazott gyógyszer(ek) vonatkozásában súlyos mellékhatások lépnek fel, az adagolás módosítása az alkalmazási előírások szerint történik.
4.3.16. Amennyiben a sofosbuvirral kombinációban alkalmazott másik gyógyszer alkalmazását véglegesen abbahagyják, akkor a sofosbuvir alkalmazását is abba kell hagyni. Sofosbuvirral monoterápia nem végezhető.
5. Az ellátás igénybevételének rendje
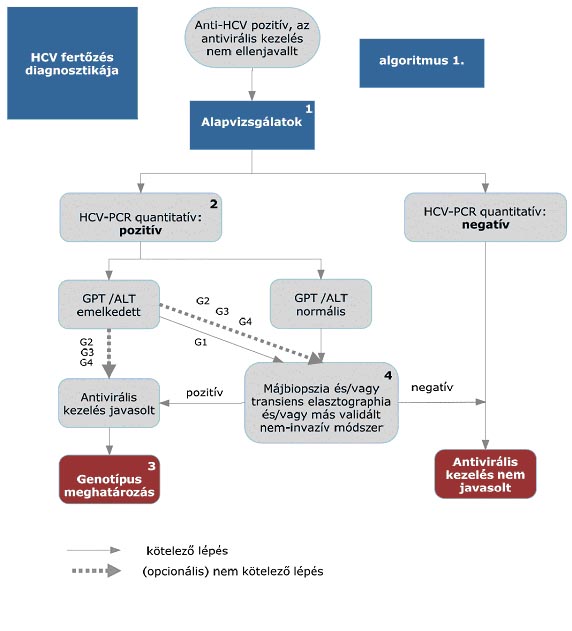
5.1. A finanszírozás rendje, a hepatitis C betegség diagnosztikus algoritmusa
5.2. Az algoritmus részletezése
5.2.1. Általános kivizsgálás
5.2.1.2. Fizikális vizsgálat
5.2.1.3. Laboratóriumi diagnosztika (vérkép, májfunkciók, glükóz, lipidek, vesefunkciók, TSH és HCV ellenanyag)
5.2.1.4. Műszeres vizsgálatok: hasi ultrahang
5.2.1.5. Differenciál diagnosztika (HIV, HAV, HBV, HDV, ANA, TSH stb.)
5.2.1.6. Igazolhatóan 6 hónapnál régebben fennálló HCV fertőzöttség esetén az aktív hepatitis fennállását a kezelés megkezdése előtti egyetlen emelkedett GPT/ALT érték is támogatja, de normál GPT/ALT érték sem zárja azt ki, és az antivirális kezelés nem ellenjavallt, ha a hepatitis fennállása szövettanilag vagy más módon igazolható (aktivitás és/vagy fibrosis).
5.2.1.7. A kezelés során laboratóriumi monitorozás szükséges: bármely új gyógyszer bevezetését követően az első 4 hétben kéthetente, majd 4–8 hetenként teljes vérkép, GPT/ALT, GOT/AST, se. bilirubin, 12 hetenként se. kreatinin, vércukor, TSH meghatározása.
5.2.1.8. A kezelés előtt vagy alatt hepatitis A és hepatitis B ellen vakcináció javasolt.
5.2.2. HCV-RNS vizsgálata molekuláris diagnosztikus módszerrel (HCV PCR)
HCV-RNS (real time RT-PCR) meghatározás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló miniszteri rendeletben meghatározott, akkreditált víruslaborban, CE jelzésű teszttel. A beteg molekuláris diagnosztikai vizsgálatait – az értékelhetőség és a követés miatt – a kezelés egész időtartama alatt lehetőség szerint azonos módszerrel és azonos laboratóriumban szükséges végezni.
5.2.2.1. HCV-RNS vizsgálat indokolt, amennyiben a beteg kezelése várhatóan szükséges és lehetséges:
5.2.2.1.1. akiknél pozitív az anti-HCV teszt, azon személyeknél a kezelés előtt célszerű szenzitív kvantitatív tesztet végezni, azzal, hogy G1 és G4 genotípus esetén a kezelés megkezdése előtt ez mindenképp kötelező;
5.2.2.1.2. akiknél bizonytalan vagy a klinikumnak ellentmondó az anti-HCV eredmény (kétes, téves pozitív vagy negatív anti-HCV eredmény);
5.2.2.1.3. kvantitatív vírus nukleinsav vizsgálat végzendő, akiknél negatív az anti-HCV teszt, de akut HCV fertőzés gyanúja áll fenn vagy immunszupprimáltak.
5.2.2.2. Olyan anti-HCV pozitív betegnél, akinél antivirális kezelés biztosan nem végezhető (például kontraindikált vagy a kezelést a beteg nem vállalja), HCV-RNS vizsgálat végzése indokolatlan.
5.2.3. Vírus genotípus meghatározás
A HCV genotípus meghatározása szükséges PRP hármas kezelés valamint az interferon-mentes kezelés előtt minden olyan betegnél, akinél a genotípus nem ismert. Amennyiben genotípus vizsgálat nem történt vagy a genotípus nem határozható meg, csak PR kettős kezelés végezhető.
5.2.4. Májbiopszia, tranziens elastographia, egyéb validált nem invazív vizsgálómódszer
Májbiopszia végezhető, ha a kezelőorvos szükségesnek tartja a máj necroinflammációjának és a fibrosis stádiumának meghatározását prognosztikus célból vagy a kezelésre vonatkozó döntéshez. A májbiopsziát kiválthatja FibroScan vizsgálat. HCV G2, G3 és G4 genotípusok esetén mellőzhető a májbiopszia és a FibroScan vizsgálat.
Az előbbi módszerek ellenjavallata/elérhetetlensége/kivitelezhetetlensége esetén más validált nem invazív vizsgáló módszer (pl. FibroTest, ELF teszt) végezhető.
5.3. A finanszírozás rendje, a krónikus hepatitis C betegség kezelési algoritmusa
A kezelési algoritmus eltér aszerint, hogy a beteget első ízben kezelik vagy korábban már részesült kezelésben. A terápia eltér a vírus genotípusa szerint is.
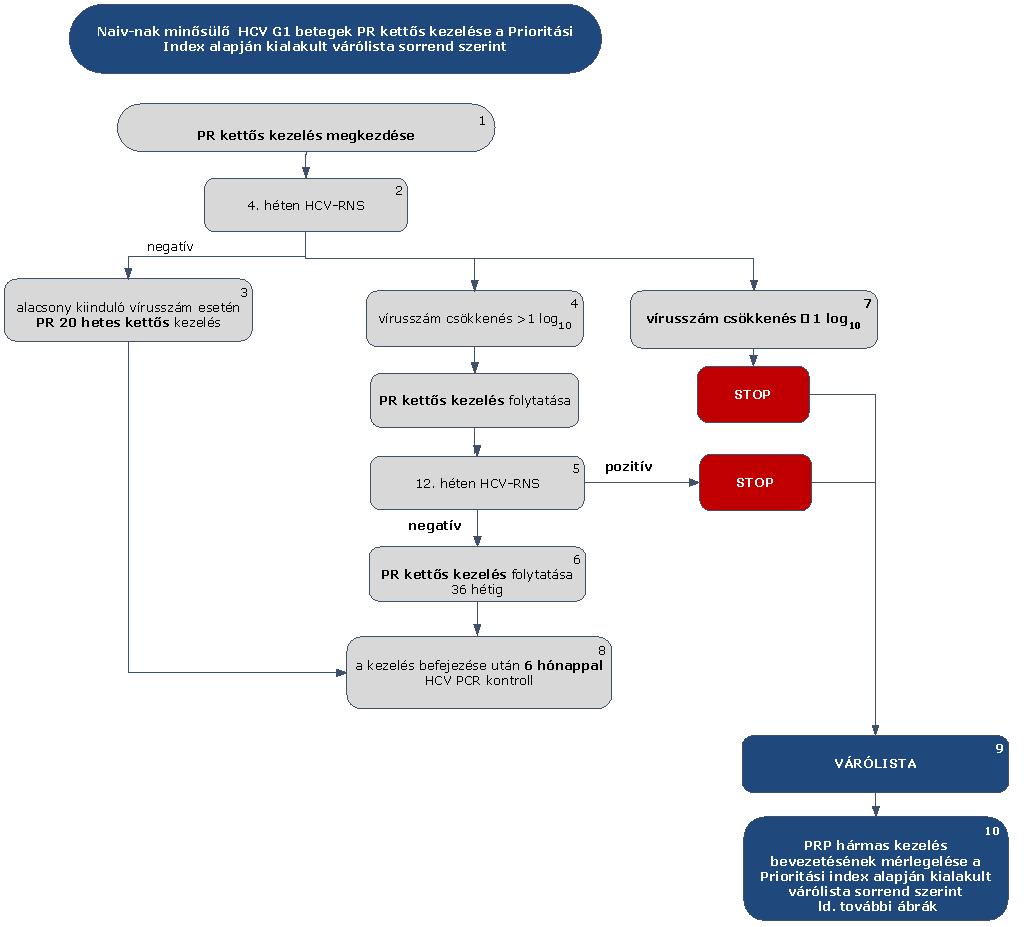
5.3.1. Finanszírozási algoritmus a naiv-nak minősülő HCV G1 betegek kezelése esetén
5.3.2. Az algoritmus részletezése
5.3.2.1. A betegek első alkalommal történő kezelését – amennyiben a Hepatitis Terápiás Bizottság által meghatározott Prioritási Index alapján kezelésbe vonhatók – PegIFN+ribavirin kettős kombinációval kell megkezdeni.
5.3.2.2. A kezelés 4. hetét követően HCV-RNS vizsgálatot kell végezni.
5.3.2.3. Amennyiben a 4. héten a HCV-RNS nem mutatható ki (negatív), a kettős kezelést kell tovább folytatni. Alacsony kiinduló vírus titerszám esetén (< 400.000 IU/ml), amennyiben nem áll fenn cirrhosis, 24 hetes PR kettős kezelés elegendő.
5.3.2.4. Amennyiben a 4. héten végzett HCV PCR alapján a kiinduló vírusszám csökkenése nagyobb, mint (1 log10), a PR kettős kezelést kell tovább folytatni.
5.3.2.5. A kezelés 12. hetét követően HCV-RNS vizsgálatot kell végezni. Amennyiben ekkor a HCV-RNS kimutatható (pozitív) a PR kettős kezelést le kell állítani STOP-szabály alapján. Amennyiben a kezelés 12. hetében HCV-RNS nem mutatható ki (negatív), PR kettős kezelést kell tovább folytatni még 36 héten át (6). A kezelés időtartama összesen 48 hét.
5.3.2.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges (8) a tartós vírusválasz megítélésére.
5.3.2.7. Amennyiben a 4. héten a vírusszám nem csökken a kiinduló vírusszám szintjének legalább tizedére (1 log10) (7), a PR kettős kezelést le kell állítani a STOP-szabály alapján.
5.3.2.8. A korábban kettős kezelésben részesült, de a STOP-szabályok miatt leállított terápiájú betegek várólistára (9) kerülnek.
5.3.2.9. Ezeknél a betegeknél további kezelés bevezetésének mérlegelése szakmailag indokolt, ők az ismételten meghatározott Prioritási Index alapján (10) a várólista sorrend szerint részesülhetnek kezelésben.
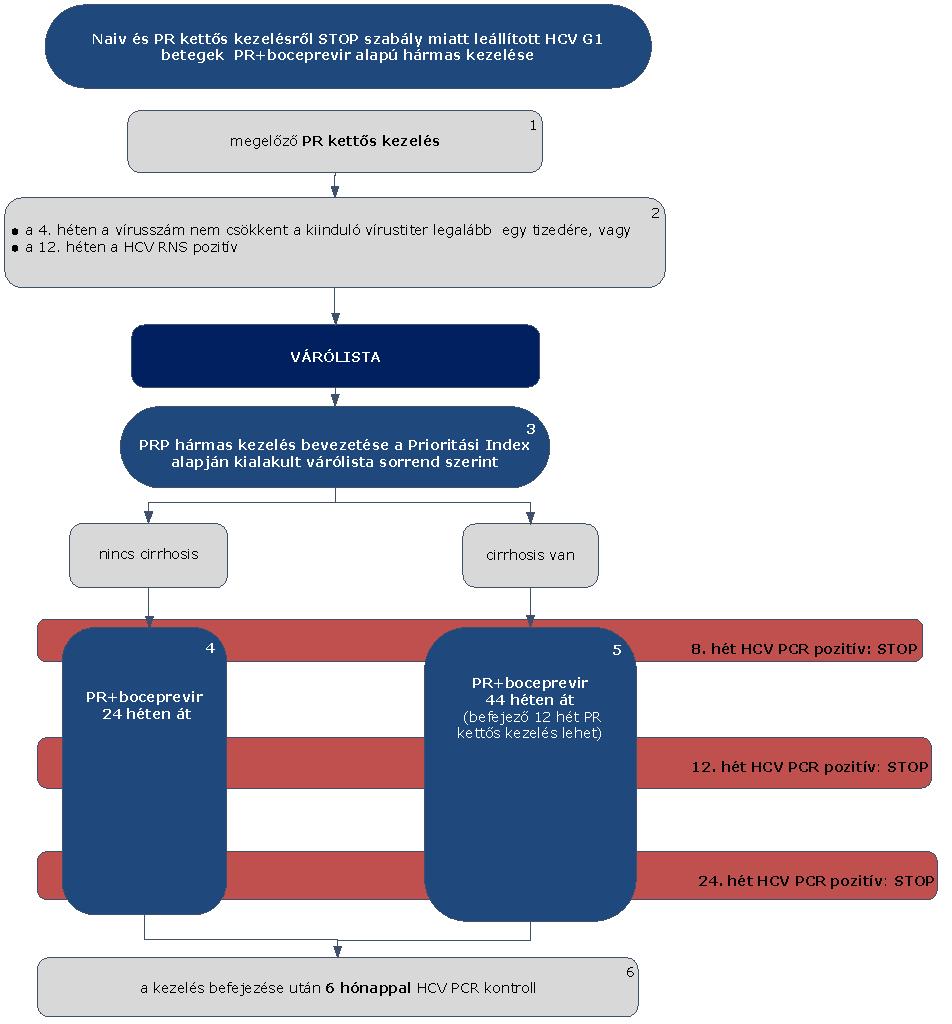
5.3.3. Finanszírozási algoritmus naiv és PR kettős kezelésről STOP-szabály miatt leállított HCV G1 betegek PR és boceprevir alapú hármas kezelése esetén
5.3.4. Az algoritmus részletezése
5.3.4.1. A betegek első alkalommal történő kezelését – amennyiben a Hepatitis Terápiás Bizottság által meghatározott Prioritási Index szerint kezelésbe vonhatók – PegIFN+ribavirin kettős kombinációval kell megkezdeni.
5.3.4.2. A PR kettős kezelést a STOP-szabály alapján le kell állítani, amennyiben a 4. héten végzett PCR szerint a vírusszám nem csökkent a kiindulási érték legalább egy tizedére, vagy a 12. héten a HCV-RNS kimutatható (pozitív) (ld. 5.3.1. ábra).
5.3.4.3. Ezek a betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek PRP hármas kezelésben vagy IFN-mentes kezelésben.
5.3.4.4. Amennyiben a betegnél a szakmai definíció (ld. fogalmak) szerint nem áll fenn cirrhosis, úgy a 4 hetes PR lead-in kezelés után további 24 hétig folytatandó a PR+boceprevir hármas kezelés. A kezelés teljes időtartama 28 hét.
5.3.4.5. Minden cirrhosisos betegnél a 4 hetes lead-in kettős kezelés után további 44 héten át kell folytatni a PR+boceprevir hármas kezelést. A kezelés teljes időtartama 48 hét. Amennyiben a beteg nem tolerálja a hármas kezelést, az utolsó 12 héten PR kettős kezelést kaphat.
5.3.4.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.3.4.7. A boceprevir alapú hármas kezelést le kell állítani (STOP-szabályok), amennyiben:
5.3.4.7.1. a 8. héten a HCV PCR pozitív
5.3.4.7.2. a 12. héten a HCV PCR pozitív
5.3.4.7.3. a 24. héten a HCV PCR pozitív.
5.3.4.8. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
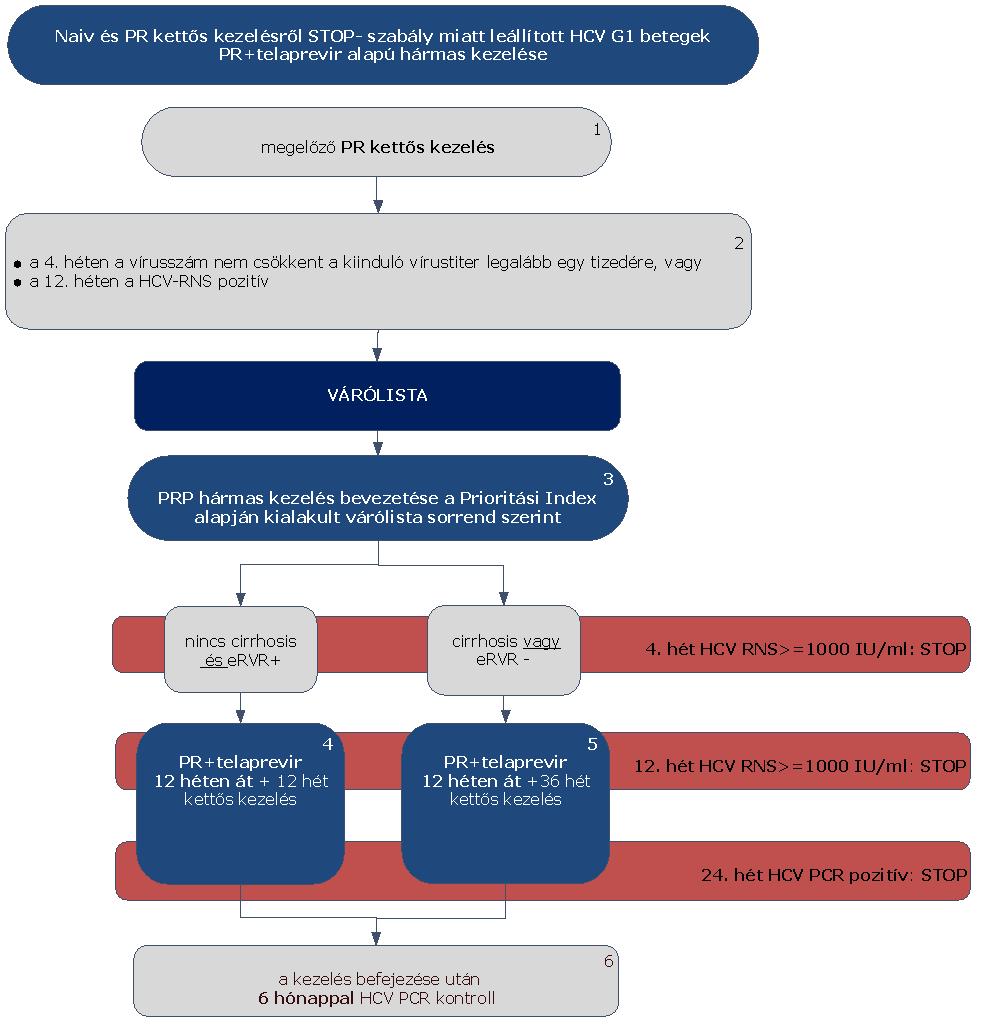
5.3.5. Finanszírozási algoritmus naiv és PR kettős kezelésről STOP-szabály miatt leállított HCV G1 betegek PR és telaprevir alapú hármas kezelése esetén:
5.3.6. Az algoritmus részletezése
5.3.6.1. A betegek első alkalommal történő kezelését – amennyiben a Hepatitis Terápiás Bizottság által meghatározott Prioritási Index szerint kezelésbe vonhatók – PegIFN+ribavirin kettős kombinációval kell megkezdeni.
5.3.6.2. A PR kettős kezelést a STOP-szabály alapján le kell állítani, amennyiben a 4. héten végzett PCR szerint a vírusszám nem csökkent a kiindulási érték legalább egy tizedére, vagy a 12. héten a HCV-RNS kimutatható (ld. 5.3.1. ábra).
5.3.6.3. Ezek a betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek PRP hármas kezelésben vagy IFN-mentes kezelésben.
5.3.6.4. A szakmai definíció szerint (ld. fogalmak) nem cirrhosisos betegek, akiknél a kiterjesztett vírusválasz (eRVR) pozitív, 12 hetes PR+ telaprevir kezelést követően még további 12 héten át PR kettős kezelésben részesülnek.
5.3.6.5. Minden cirrhosisos betegnél, vagy akiknél az eRVR negatív, a 12 hetes PR+telaprevir hármas kezelést 36 hétig tartó PR kettős kezelés zárja le.
5.3.6.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.3.6.7. A telaprevir alapú hármas kezelést le kell állítani (STOP-szabályok), amennyiben:
5.3.6.7.1. a 4. héten: HCV-RNS ≥ 1000 IU/ml,
5.3.6.7.2. a 12. héten: HCV-RNS ≥ 1000 IU/ml,
5.3.6.7.3. a 24. héten: HCV PCR pozitív.
5.3.6.8. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
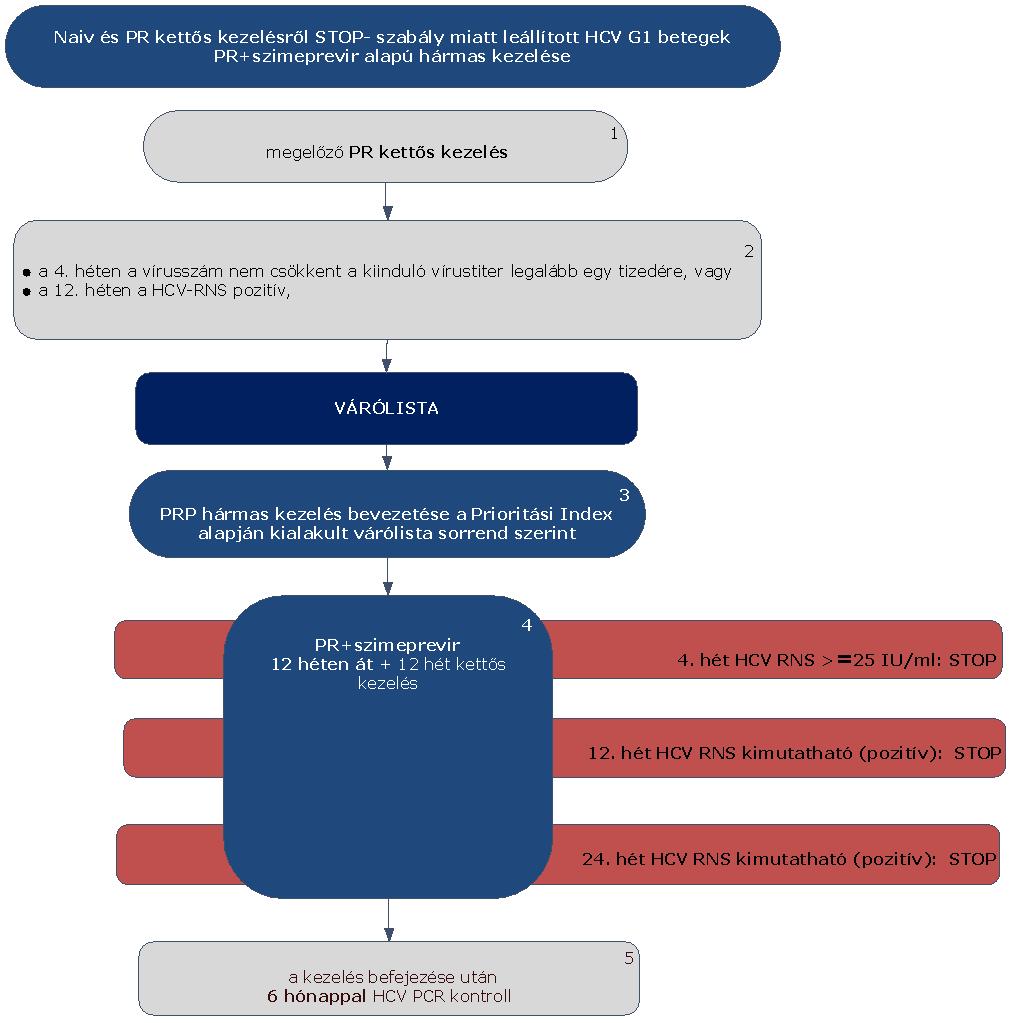
5.3.7. Finanszírozási algoritmus naiv és PR kettős kezelésről STOP-szabály miatt leállított HCV G1 betegek PR és szimeprevir alapú hármas kezelése esetén:
5.3.8. Az algoritmus részletezése
5.3.8.1. A betegek első alkalommal történő kezelését – amennyiben Terápiás Bizottság által meghatározott Prioritási Index szerint kezelésbe vonhatók – PegIFN+ribavirin kettős kombinációval kell megkezdeni.
5.3.8.2. A PR kettős kezelést a STOP-szabály alapján le kell állítani, amennyiben a 4. héten végzett PCR szerint a vírusszám nem csökkent a kiindulási érték legalább egy tizedére, vagy a 12. héten a HCV-RNS kimutatható (pozitív) (ld. 5.3.1. ábra).
5.3.8.3. Ezek a betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek PRP hármas kezelésben, vagy IFN-mentes kezelésben. (3)
5.3.8.4. A betegek PR+szimeprevir hármas kombinációs kezelése 12 hétig tart – kivétel a HIV társfertőzött cirrhosisos betegek –, amelyet további 12 hétig peginterferon alfa és ribavirin kettős kezelés követ, amennyiben a terápiát STOP szabály miatt nem kell leállítani. (4) A kezelés teljes időtartama 24 hét.
5.3.8.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére. (5)
5.3.8.6. A szimeprevir alapú hármas kezelést le kell állítani (STOP-szabályok), amennyiben:
5.3.8.6.1. a 4. héten: HCV-RNS ≥ 25 IU/ml,
5.3.8.6.2. a 12. héten: HCV-RNS kimutatható (PCR pozitív) vagy
5.3.8.6.3. a 24. héten: HCV-RNS kimutatható (PCR pozitív).
5.3.8.7. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
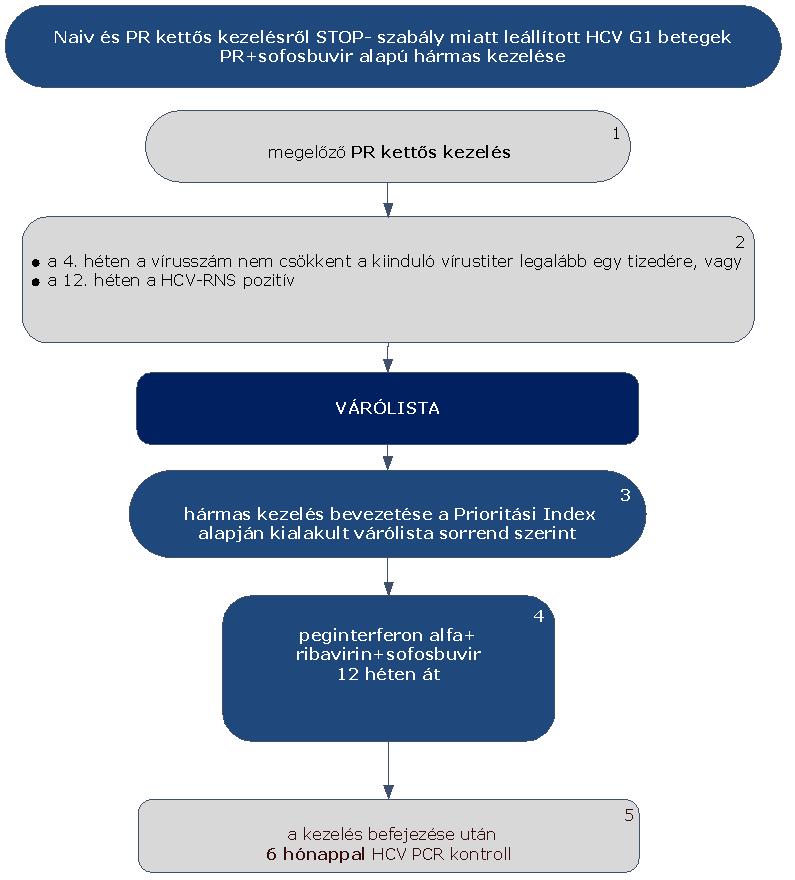
5.3.9. A naiv és PR kettős kezelésről STOP-szabály miatt leállított HCV G1 betegek PR és sofosbuvir alapú hármas kezelése esetén:
5.3.9.1. A betegek első alkalommal történő kezelését – amennyiben a Hepatitis Terápiás Bizottság által meghatározott Prioritási Index szerint kezelésbe vonhatók – PegIFN+ribavirin kettős kombinációval kell megkezdeni.
5.3.9.2. A PR kettős kezelést a STOP-szabály alapján le kell állítani, amennyiben a 4. héten végzett PCR szerint a vírusszám nem csökkent a kiindulási érték legalább egy tizedére, vagy a 12. héten a HCV-RNS kimutatható (ld. 5.3.1. ábra).
5.3.9.3. Ezek a betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek PR+sofosbuvir hármas kezelésben,.
5.3.9.4. A betegek PR+sofosbuvir hármas kombinációs kezelése 12 hétig tart. Negatív prediktorok fennállása esetén megfontolandó a 24 hetes terápia.
5.3.9.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.3.9.6. A sofosbuvir alapú hármas kezelés leállítására vonatkozó STOP szabály nem ismert.
5.3.9.7. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
5.3.10. Finanszírozási algoritmus ismételt kezelés esetén
5.3.10.1. Korábban PR kombinációval sikertelenül kezelt betegek PRP (PegIFN+RBV+PI) hármas kezelése.
5.3.10.1.1. A finanszírozási eljárásrend szempontjából „korábban sikertelenül kezelt” betegnek tekinthetők mindazok, akik korábban PegIFN+RBV kezelés során nem váltak PCR negatívvá vagy vírusáttörés, illetve relapszus volt tapasztalható.
5.3.10.1.2. A korábban PR kettős kezelésben részesült, de a STOP-szabály miatt a kezelésből kieső betegek várólistára kerülnek, és a hármas (PRP) kombinációs kezelésbe történő bevonásuk a szakmai konszenzuson alapuló Prioritási Index alapján a Hepatitis Terápiás Bizottság engedélye szerint történik.
5.3.10.2. PRP hármas kezeléskor a háromféle proteáz inhibitor (PI) készítmény (boceprevir, illetve telaprevir/szimeprevir) bármelyike alkalmazható, de az alkalmazás módja, ideje, a rendelkezésre álló evidenciák és a mellékhatások különbözőségei befolyásolhatják az egyes betegeknél a PI választást.
5.3.10.2.1. Költséghatékonysági szempontból a boceprevir alapú hármas kezelés javasolt olyan betegeknél, akiknél nagy az esélye annak, hogy hatástalanság miatt a PRP hármas kezelést az első 12 héten belül be kell fejezni. Ilyen betegek lehetnek például a korábbi kezelés során null-reagáló cirrhosisos betegek.
5.3.10.2.2. A korábban PR kettős kezelés után relabáló nem cirrhotikus betegek számára – a rövidebb kezelés lehetősége miatt, költséghatékonysági szempontból – a telaprevir/szimeprevir látszik célszerűbbnek.
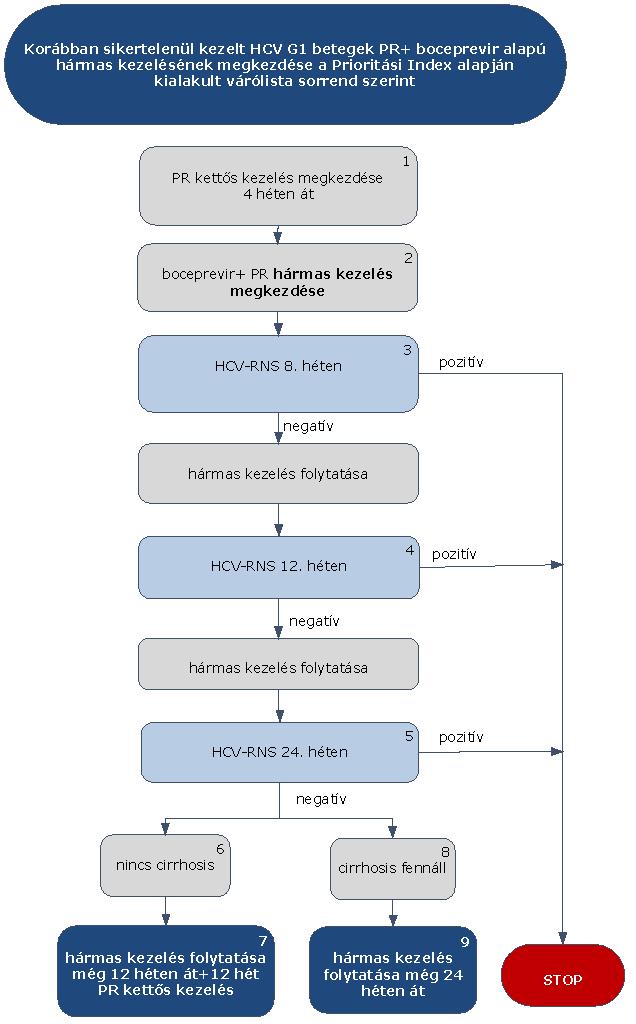
5.3.11. Korábban sikertelenül kezelt HCV G1 betegek PR+ boceprevir alapú hármas kezelése:
5.3.12. Az algoritmus részletezése
A korábban sikertelenül kezelt HCV G1 betegek PR+ boceprevir alapú hármas kezelésének megkezdése az ismételten meghatározott Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.12.1. A kezelés 4 hetes PR kettős kezeléssel indul (pegilált interferon/ribavirin kombináció), függetlenül attól, hogy a betegnél cirrhosis fennáll vagy nem. A kezelés kizárólag verifikált G1 genotípus esetén kezdhető meg.
5.3.12.2. A 4 hetes PR lead-in kettős kezelést követően egészül ki a terápia boceprevirrel. (2)
5.3.12.3. A kezelés 8., 12. és 24 hetében HCV-RNS vizsgálat (3, 4, 5) szükséges. Amennyiben ezen időpontokban végzett vizsgálatok során a HCV-RNS kimutatható (pozitív), a STOP-szabály alapján a kezelés megszakítandó.
5.3.12.4. Amennyiben a beteg a szakmai definíció szerint (ld. fogalmak) nem cirrhosisos (6), a hármas kezelés tovább folytatható még 12 hétig, amelyet további 12 hét PR kettős kezelés zár le (7). A kezelés teljes időtartama 48 hét.
5.3.12.5. Amennyiben a betegnél fennáll a cirrhosis (8), a hármas kezelés tovább folytatható még 24 hétig (9). A kezelés teljes időtartama ezen betegek esetében is összesen 48 hét.
5.3.12.6. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
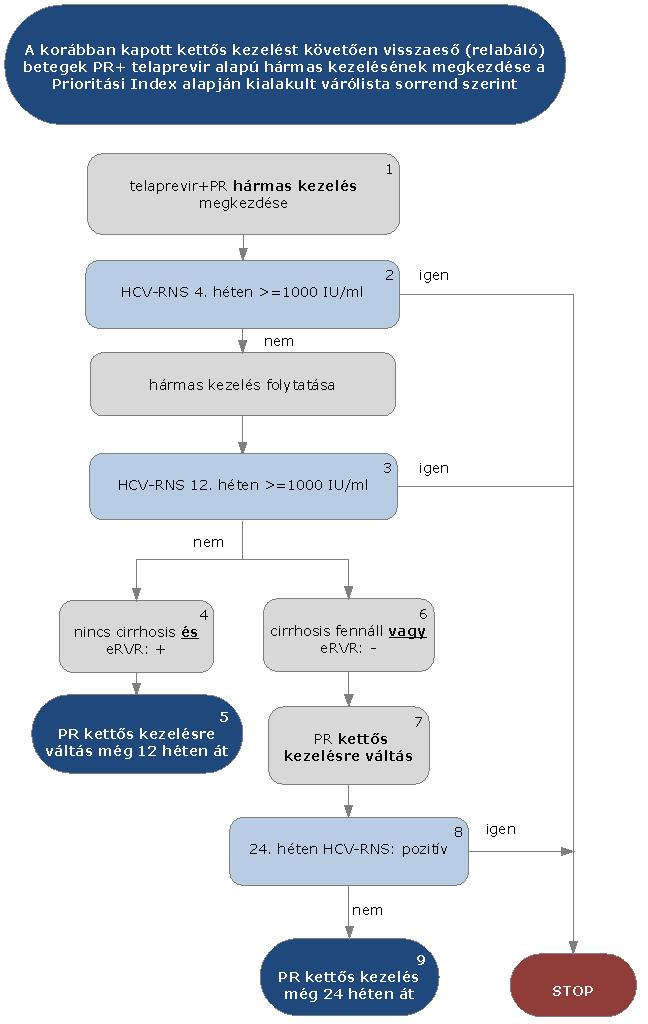
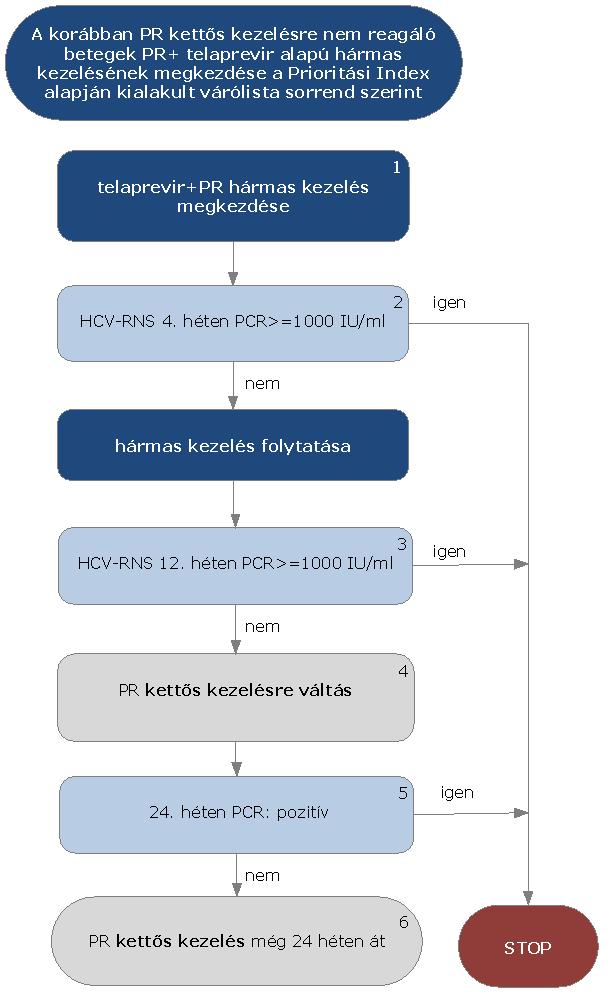
5.3.13. Korábban sikertelenül kezelt HCV G1 betegek PR+ telaprevir alapú hármas kezelése a korábban kapott kettős kezelést követően visszaeső (relabáló) betegeknél:
5.3.14. Az algoritmus részletezése
A korábban sikertelenül kezelt, a kettős kezelést követően visszaeső HCV G1 betegek PR+ telaprevir alapú hármas kezelésének megkezdése az ismételten meghatározott Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.14.1. A kezelés PR+ telaprevir hármas kombinációval kezdhető, lead-in periódus nem szükséges. A kezelés jelen esetben is kizárólag verifikált G1 genotípus esetén kezdhető meg.
5.3.14.2. A kezelés 4. hetében HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS szint 4 hét kezelés után > 1000 IU/ml, a STOP-szabály alapján a kezelést meg kell szakítani. Amennyiben a vírusszám ez alatt van, a hármas kezelés tovább folytatható.
5.3.14.3. A kezelés 12. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS 12 hét kezelés után > 1000 IU/ml, a STOP-szabály alapján a kezelést meg kell szakítani.
5.3.14.4. A nem cirrhosisos betegeknél és akiknél eRVR tapasztalható (kiterjesztett rapid vírusválasz: pozitív), további
12 héten át PR kettős kezelés folytatható. A kezelés teljes időtartama 24 hét.
5.3.14.5. Amennyiben a betegnél cirrhosis fennáll (ld. alapfogalmak) vagy eRVR nem tapasztalható (kiterjesztett rapid vírusválasz: negatív), további 12 héten át PR kettős kezelés folytatható.
5.3.14.6. Ezen betegeknél a kezelés 24. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS 24 hét kezelés után is detektálható (pozitív), a STOP-szabály alapján a kezelést meg kell szakítani.
5.3.14.7. Amennyiben ekkor vírus nem detektálható, a kettős kezelés tovább folytatható még 24 hétig. A kezelés teljes időtartama 48 hét.
5.3.14.8. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
5.3.15. Korábban kapott kettős kezelésre nem reagáló betegek (parciális, null-responder betegek) kezelése:
5.3.16. Az algoritmus részletezése
A korábban kapott kettős kezelésre nem reagáló HCV G1 betegek PR+ telaprevir alapú hármas kezelésének megkezdése az ismételten meghatározott Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.16.1. A kezelés PR+ telaprevir hármas kombinációval kezdhető, lead-in periódus nem szükséges. A kezelés jelen esetben is kizárólag verifikált G1 genotípus esetén kezdhető meg.
5.3.16.2. A kezelés 4. hetében HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS szint 4 hét kezelés után >= 1000 IU/ml, a STOP-szabály alapján a kezelés megszakítandó. Amennyiben a vírusszám ez alatt van, a hármas kezelés tovább folytatható.
5.3.16.3. A kezelés 12. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS 12 hét kezelés után >= 1000 IU/ml, a STOP-szabály alapján a kezelés megszakítandó.
5.3.16.4. Amennyiben a HCV-RNS 12 hét kezelés után 1000 IU/ml alatt marad, PR kettős kezelés folytatható tovább.
5.3.16.5. A kezelés 24. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV PCR 24 hét kezelés után kimutatható (pozitív), a STOP-szabály alapján a kezelés megszakítandó.
5.3.16.6. Amennyiben a HCV-RNS 24 hét kezelés után negatívvá válik, PR kettős kezelés folytatható tovább még 24 héten át (összesen 36 hét PR kettős kezelés). A kezelés teljes időtartama 48 hét.
5.3.16.7. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
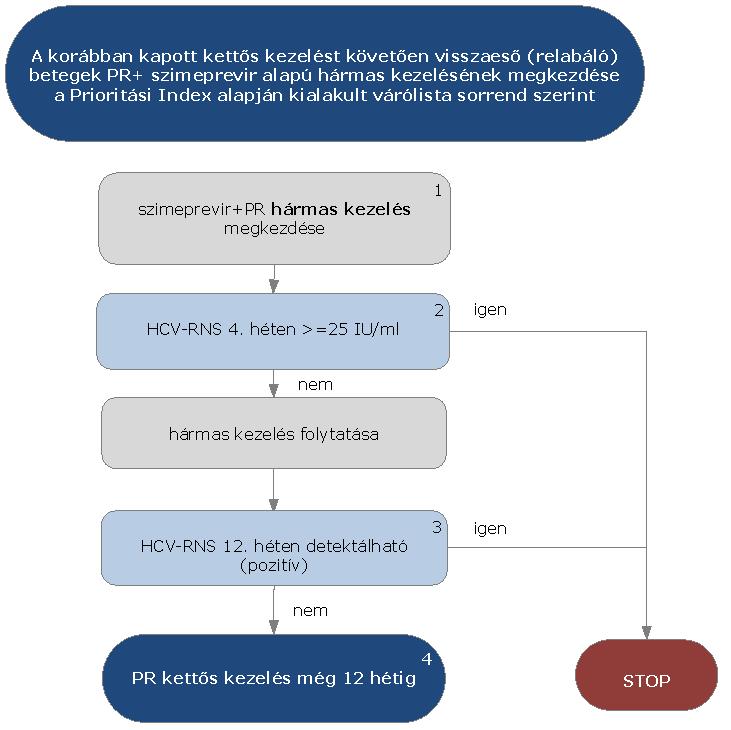
5.3.17. A korábban kapott kettős kezelést követően visszaeső (relabáló) HCV G1 betegek PR+ szimeprevir alapú hármas kezelése:
5.3.18. Az algoritmus részletezése
A korábban sikertelenül kezelt, a kettős kezelést követően visszaeső (relabáló) HCV G1 betegek PR+ szimeprevir alapú hármas kezelésének megkezdése az ismételten meghatározott Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.18.1. A kezelés PR+ szimeprevir hármas kombinációval kezdhető, lead-in periódus nem szükséges. A kezelés jelen esetben is kizárólag verifikált G1 genotípus esetén kezdhető meg.
5.3.18.2. A kezelés 4. hetében HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS szint 4 hét kezelés után >= 25 IU/ml, a STOP-szabály alapján a kezelést le kell állítani. Amennyiben a vírusszám ez alatt van, a hármas kezelés tovább folytatható.
5.3.18.3. A kezelés 12. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS 12 hét kezelés után is detektálható (PCR pozitív), a STOP-szabály alapján a kezelést le kell állítani.
5.3.18.4. Amennyiben a HCV-RNS 12 hét kezelés után nem detektálható, PR kettős kezelés folytatható tovább szimeprevir nélkül. A kezelés teljes időtartama 24 hét.
5.3.18.5. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
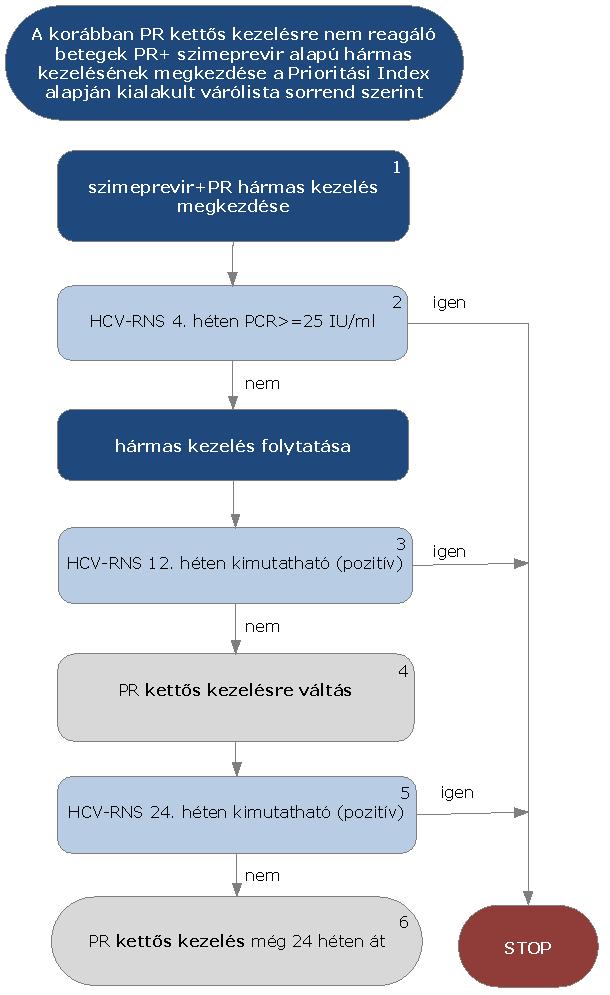
5.3.19. Korábban kapott kettős kezelésre nem reagáló betegek (parciális, null-responder betegek) PR+ szimeprevir alapú hármas kezelése:
5.3.20. Az algoritmus részletezése
A korábban kapott kettős kezelésre nem reagáló HCV G1 betegek PR+ szimeprevir alapú hármas kezelésének megkezdése az ismételten meghatározott Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.20.1. A kezelés PR+ szimeprevir hármas kombinációval kezdhető, lead-in periódus nem szükséges. A kezelés jelen esetben is kizárólag verifikált G1 genotípus esetén kezdhető meg.
5.3.20.2. A kezelés 4. hetében HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS szint 4 hét kezelés után ≥ 25 IU/ml, a STOP-szabály alapján a kezelést le kell állítani. Amennyiben a vírusszám ez alatt van, a hármas kezelés tovább folytatható.
5.3.20.3. A kezelés 12. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV-RNS 12 hét kezelés után kimutatható (PCR pozitív), a STOP-szabály alapján a kezelést le kell állítani.
5.3.20.4. Amennyiben a HCV-RNS 12 hét kezelés után nem kimutatható, PR kettős kezelés folytatható tovább szimeprevir nélkül.
5.3.20.5. A kezelés 24. hetében ismét HCV-RNS vizsgálat szükséges. Amennyiben a HCV PCR 24 hét kezelés után kimutatható (PCR pozitív), a STOP-szabály alapján a kezelést le kell állítani.
5.3.20.6. Amennyiben a HCV-RNS a 24 hét kezelés után nem kimutatható, PR kettős kezelés folytatható tovább még 24 héten át (összesen 36 hét PR kettős kezelés). A kezelés teljes időtartama 48 hét.
5.3.20.7. Ez a kezelési séma alkalmazható a HIV társfertőzött cirrhosisos betegek esetében is.
5.3.20.8. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
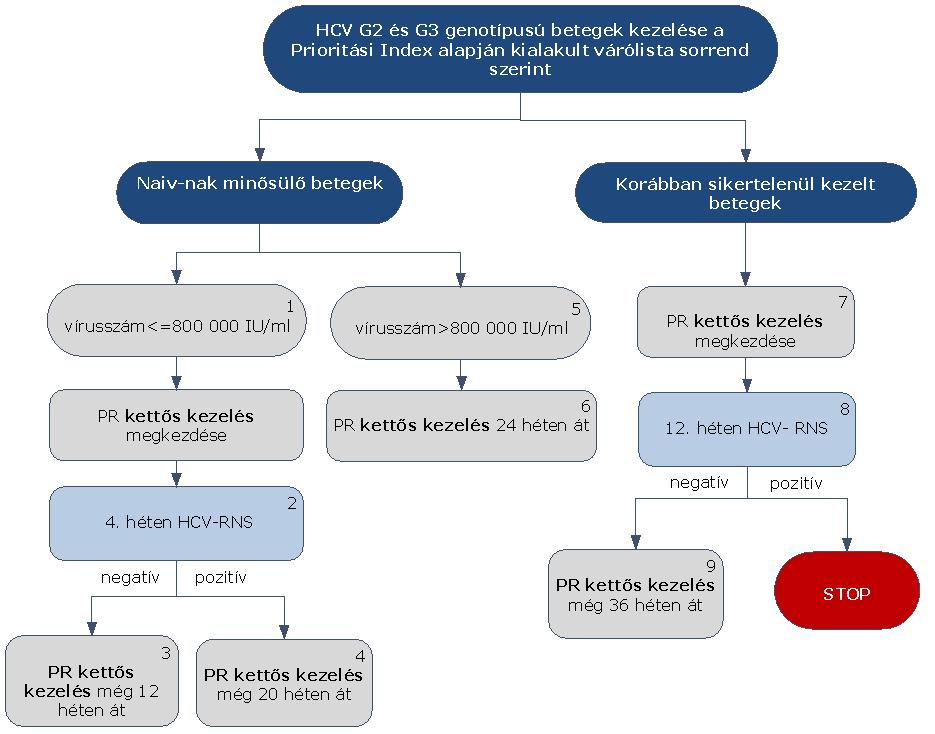
5.3.21. A HCV G2 vagy HCV G3 genotípusú betegek PR kettős kezelése, a korábban kettős kezelésben még nem részesültek (naiv-nak minősülő), valamint a korábban sikertelenül kezelt betegek egyaránt:
5.3.22. Az algoritmus részletezése
A HCV G2 és G3 genotípusú betegek kezelése PR kettős kezeléssel történik, függetlenül attól, hogy korábban részesültek-e már terápiában vagy nem. A kettős kezelés megkezdése esetükben is a Prioritási Index alapján kialakult várólista sorrend szerint történik.
A betegek kezelési stratégiája eltér a kiindulásnál regisztrált vírusszámtól függően. A korábban kettős kezelésben még nem részesült betegek esetében alacsony vírusszám (≤ 800.000 IU/ml) mellett PR kettős kezelés kezdhető. A kezelés 4. hetében HCV-RNS vizsgálat szükséges.
5.3.22.1. Amennyiben a HCV PCR 4 hét kezelés után vírust nem mutat ki (negatív), a kettős kezelés tovább folytatható még 12 héten át (terápia hossza összesen 16 hét).
5.3.22.2. Amennyiben a HCV PCR 4 hét kezelés után pozitív, a kettős kezelés tovább folytatható még 20 héten át (a terápia hossza összesen 24 hét).
5.3.22.3. A magas vírusszám (> 800.000 IU/ml) esetén, korábban kettős kezelésben még nem részesült betegek a PR kettős kezelést 24 héten át kaphatják.
5.3.22.4. A korábban sikertelenül kezelt betegek esetében a kiinduló vírustiter nem befolyásolja a kettős kezelést, a 4. héten nem szükséges PCR vizsgálatot végezni.
5.3.22.5. HCV-RNS szint meghatározás szükséges a 12. héten. Amennyiben a HCV PCR 12 hét kezelés után vírust nem mutat ki (negatív), a kettős kezelés tovább folytatható még 36 héten át (a terápia hossza összesen 48 hét).
5.3.22.6. Amennyiben a HCV PCR 12 hét kezelés után pozitív, a STOP-szabály alapján a kezelés megszakítandó.
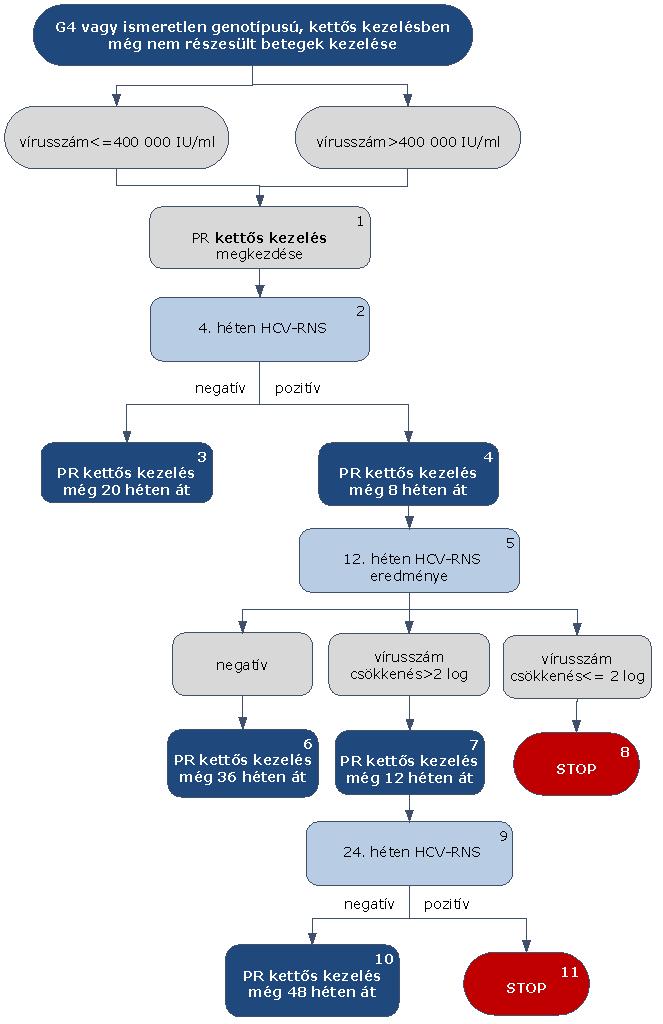
5.3.23. A HCV G4 vagy ismeretlen genotípusú, kettős kezelésben még nem részesült betegek kezelése:
5.3.24. Az algoritmus részletezése
A HCV G4 vagy ismeretlen genotípusú, PR kettős kezelésben még nem részesült betegek kezelése függetlenül a kiinduló vírusszámtól PR kettős kezeléssel történik. A kettős kezelés megkezdése esetükben is a Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.24.1. A HCV G4 vagy ismeretlen genotípusú, kettős kezelésben még nem részesült betegek esetében kiinduló vírusszámtól függetlenül PR kettős kezelés kezdhető.
5.3.24.2. A kezelés 4. hetében HCV-RNS vizsgálat szükséges.
5.3.24.3. Amennyiben alacsony kiinduló vírusszám (< 400.000 IU/ml) esetén a HCV PCR 4 hét kezelés után nem mutat ki vírust (negatív), a kettős kezelés tovább folytatható még 20 héten át (a terápia hossza összesen 24 hét).
5.3.24.4. Amennyiben a HCV PCR 4 hét kezelés után pozitív, a kettős kezelés tovább folytatható 8 héten át.
5.3.24.5. A kezelés 12. hetében HCV-RNS vizsgálat szükséges. Amennyiben a HCV PCR 12 hét kezelés után negatív, a kettős kezelés tovább folytatható még 36 héten át (a terápia hossza összesen 48 hét).
5.3.24.6. Amennyiben a HCV-RNS szint 12 hét kezelést követően pozitív, a kezelést STOP-szabály miatt fel kell függeszteni.
5.3.24.7. A 12 hetes kezelést követően vírusmentessé vált betegeknél a terápia 24. hetében ismételt PCR-RNS vizsgálat elvégzése indokolt.
5.3.24.8. Amennyiben a HCV PCR 24 hét kezelés után negatív, a kettős kezelés tovább folytatható még 48 héten át (a terápia hossza összesen 72 hét).
5.3.24.9. Amennyiben a HCV PCR 24 hét kezelés után pozitív, a STOP-szabály alapján a kezelés megszakítandó.
5.3.24.10. A STOP-szabály alá eső betegek várólistára kerülnek, majd az ismételten meghatározott Prioritási Index alapján a várólista sorrend szerint részesülhetnek további kezelésben.
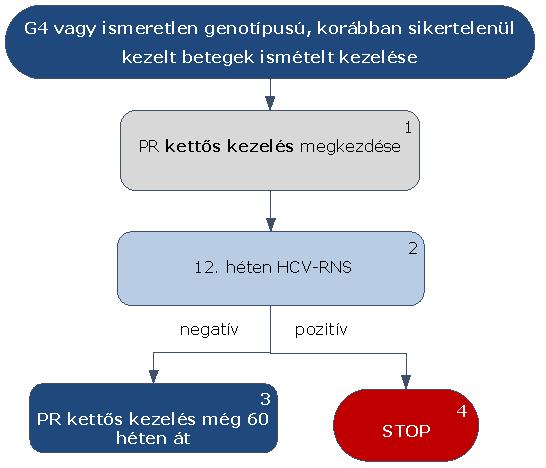
5.3.25. A HCV G4 vagy ismeretlen genotípusú, korábban sikertelenül kezelt betegek kezelése:
5.3.26. Az algoritmus részletezése
A HCV G4 vagy ismeretlen genotípusú, korábban sikertelenül kezelt betegek ismételt kezelése PR kettős kezeléssel történik. A kettős kezelés megkezdése esetükben is a Prioritási Index alapján kialakult várólista sorrend szerint történik.
5.3.26.1. A HCV G4 vagy ismeretlen genotípusú, korábban sikertelenül kezelt betegek esetében kiinduló vírusszámtól függetlenül PR kettős kezelés kezdhető.
5.3.26.2. A kezelés 12. hetében HCV-RNS vizsgálat szükséges.
5.3.26.3. Amennyiben a HCV-RNS szint 12 hét kezelést követően negatív, a kettős kezelés tovább folytatható még 60 héten át.
5.3.26.4. Amennyiben a HCV-RNS szint 12 hét kezelést követően pozitív, a STOP-szabály alapján a kezelés megszakítandó. A terápia hossza a kiinduló vírusszinttől függetlenül 72 hét.
6.1. Fenntartó természetes interferon kezelés (STOP-szabály miatt kiesett betegek, extrahepatikus manifesztációk és igazoltan IFN alfa-2 ellenes neutralizáló antitestek miatt nem reagáló vagy relabáló beteg).
6.1.1. Az IFN/PegIFN±RBV±PI terápiából STOP-szabály miatt kiesett betegek liofilizált természetes human leukocita IFN-nal kezelhetők, az eredetileg tervezett időtartamig.
6.1.2. A kezelés a biokémiai remisszió fenntartása érdekében – engedélyezést követően – egy éven túl is folytatható, illetve biokémiai relapszus esetén ismételhető.
6.1.3. Extrahepaticus manifesztáció (pl. cryoglobulinaemiás vasculitis) esetén egy évig akkor is végezhető természetes IFN kezelés, ha a GPT/ALT érték és a szövettan alapján májérintettség nem bizonyítható. Indokolt esetben a kezelés egy év után meghosszabbítható.
6.1.4. Igazoltan IFN alfa-2 ellenes neutralizáló antitestek miatt nem reagáló vagy relabáló betegnél (beleértve a break through jelenséget is) az ilyen antitestek jelenléte esetén is igazoltan hatékony természetes IFN±RBV-nel teljes dózisú és időtartamú ismételt kezelés végezhető.
6.1.5. A PI kezeléssel történő kombinálásra nincsen adat, így nem ajánlott.
6.2.1. PR kettős kezelés esetén a kezelési mód megválasztása a szérum kreatinin szinttől és/vagy a kreatinin clearance-től függ.
6.2.2. PegIFN alfa-2a + RBV (Copegus) kombinált kezelés – megfelelő monitorozás mellett, dóziscsökkentéssel – beszűkült vesefunkciók esetén is végezhető.
6.2.3. PegIFN alfa-2b + RBV (Rebetol) 200 µmol/l feletti kreatinin és/vagy 50 ml/perc alatti kreatinin clearance esetén ellenjavallt.
6.2.4. PegIFN alfa-2b monoterápia végezhető beszűkült vesefunkció esetén (15–50 ml/perc kreatinin clearance) az alkalmazási előírásban rögzített dóziscsökkentéssel.
6.2.5. Haemodialysalt betegek kombinált antivirális kezelése csak akkor indokolt, ha a beteg vesetranszplantációra is esélyes.
6.2.6. Haemodialysalt betegek esetén PegIFN alfa-2a javasolt, 135 µg/hét dózisban. Nagy körültekintéssel, naponta vagy másnaponta 200 mg RBV (Copegus) adható.
6.2.7. A kezelés időtartamát a nem vesebetegekre vonatkozó szabályok határozzák meg.
6.2.8. IFN-mentes kezelési lehetőségek szintén mérlegelhetők.
6.3. Extrahepatikus manifesztáció (pl. cryoglobulinaemia)
6.3.1. Amennyiben májérintettség bizonyítható, akkor a kezelés megfelel az előzőekben leírtaknak. A PR kettős kezelés eredménytelensége esetén PRP hármas kezelés végezhető.
6.3.2. Ha a GPT/ALT érték és a szövettan alapján májérintettség nem bizonyítható, IFN kezelés végezhető.
6.3.3. A tünetekkel járó cryoglobulinaemia kezelése általában hosszabb időtartamot vesz igénybe, emiatt az IFN monoterápia hosszabbítható.
6.3.4. IFN-mentes kezelési lehetőségek szintén mérlegelhetők.
6.4. Ribavirin ellenjavallata esetén
6.4.1. A fenti dózisú PegIFN vagy – ha az nem végezhető – StdIFN monoterápia végezhető. RBV nélküli IFN/PegIFN terápia kombinálása PI kezeléssel rezisztencia kialakulása miatt tilos.
6.5. Thrombopenia vagy leukopenia
6.5.1. Standard interferon (StdIFN) kezelés kifejezett thrombopenia vagy leukopenia hajlam esetén végezhető, de ilyenkor is mérlegelendő csökkentett dózisú PegIFN±RBV terápia végzése. A StdIFN dózisa: heti 3x3–6 ME, mely – ha nem ellenjavallt – a fenti dózisú RBV-nel kombinálandó. A PI kezeléssel történő kombinálásra nincsen adat, így nem ajánlott.
6.5.2. IFN-mentes kezelési lehetőségek szintén mérlegelhetők.
6.6.1. A 8–12. héten a HCV-RNS vizsgálat pozitivitása esetén 24 hetes PegIFN monoterápia javasolt.
6.7.1. Három éves kor felett indokolt esetben gyermekgyógyász és hepatológus együttes javaslata alapján 48 hetes PR kettős kezelés javasolható. Dozírozás az alkalmazási előírás szerint. 18 éves kor alatt PI alkalmazása tapasztalat hiányában nem megengedett.
6.8. HIV és HCV koinfekció
6.8.1. Minden genotípus esetén a HIV koinfectio nélküli kezelési stratégiával, de a cirrhosisosokhoz hasonlóan minden esetben 48 hétig kezelendő (azaz HCV G1, korábban sikertelenül kezelt betegek kezelésében a proteáz gátlókat hasonlóan kell alkalmazni, mint HCV monoinfekció esetén).
6.8.2. Aktív retrovirális kezelés, illetve < 200/µl CD4 sejtszám esetén fokozott ellenőrzés indokolt a tejsav acidosis, illetve a cytopenia lehetősége miatt.
6.8.3. A gyógyszerkölcsönhatásokra fokozott figyelmet kell fordítani.
6.8.4. IFN-mentes kezelési lehetőségek szintén mérlegelhetők.
6.9.1. Májtranszplantált betegeknél kialakuló új HCV fertőzés (vagy rekurrencia) a rejekció lehetőségének kizárását követően korán kezelendő. A kezelés fokozott ellenőrzés mellett történhet, lehetőség szerint a transzplantációt végző intézmény irányítása mellett.
6.9.2. Proteáz-gátlók alkalmazásával egyelőre kevés tapasztalattal rendelkezünk, de alkalmazásuk megfelelő elővigyázatossággal, szoros immunszuppresszív gyógyszerszint monitorozás mellett nem kontraindikált.
6.9.3. IFN-mentes kezelési lehetőségek mérlegelhetők, az IFN-mentes kezelések időtartama általában 24 hét.
6.10. Pozitív addiktológiai anamnézisű beteg
6.10.1. Az IFN kezelés megkezdése előtt a manifeszt pszichiátriai zavar (különös tekintettel a depresszióra és a szorongásos kórképekre) kizárása szükséges.
6.10.2. Ha kábítószer használatára pozitív az anamnézis, akkor a kombinált antivirális kezelés 3 hónapos – legalább két negatív drogteszttel igazolt – absztinencia után kezdhető meg. Az addiktológus által rendelt fenntartó suboxone vagy methadon kezelés nem minősül kontraindikációnak.
7. Interferon mentes terápiák
7.1. Alapvető megfontolások
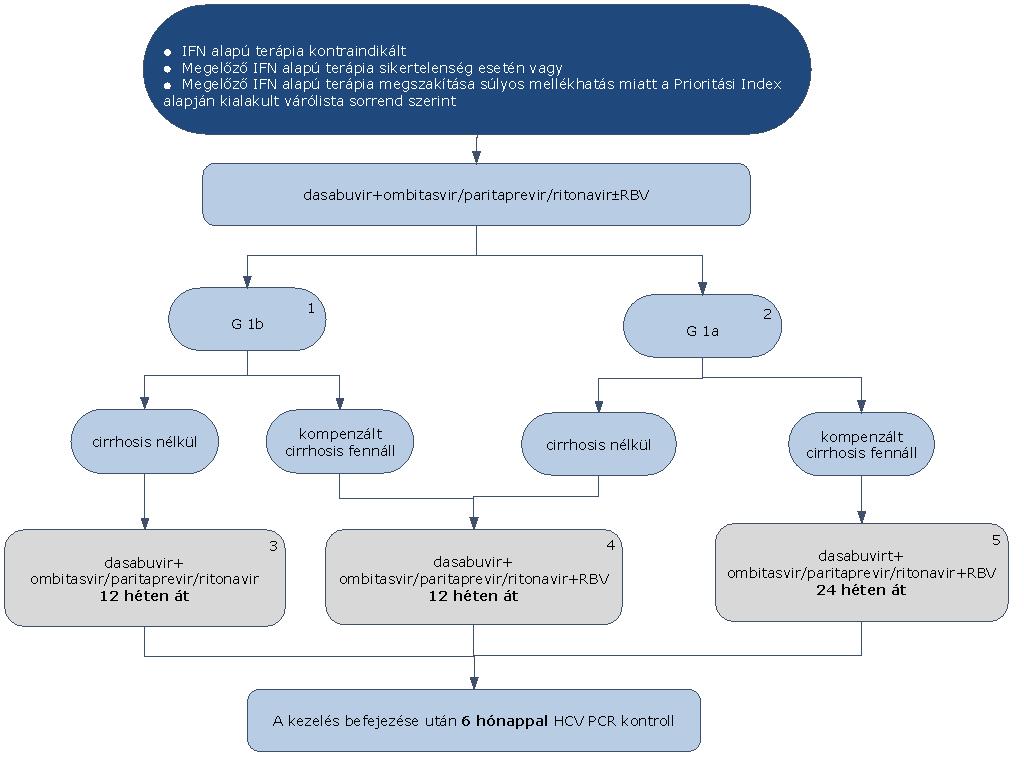
7.1.1. Az interferon mentes terápiák kizárólag azon HCV G1 fertőzésben szenvedő betegek esetében alkalmazhatók OEP finanszírozással, akik esetében kontraindikált az interferon alapú terápia, vagy a megelőző interferon alapú kezelés sikertelen volt, vagy súlyos mellékhatások miatt annak megszakítására került sor.
7.1.2. Gyógyszerkészítmények
7.1.3. Daclatasvir NS5A inhibitor specifikus alkalmazási szempontok
7.1.3.1. Adagolás: naponta egyszer 60 mg, per os, étellel együtt, vagy anélkül bevéve (ld. alkalmazási előírás).
7.1.3.2. A daclatasvirt más gyógyszerekkel kombinációban kell alkalmazni. A kezelés megkezdése előtt el kell olvasni a terápiás sémában alkalmazott egyéb gyógyszerek alkalmazási előírásait.
7.1.3.3. A leggyakoribb mellékhatások:
7.1.3.3.1. általános tünetek: fáradtság
7.1.3.3.2. anyagcsere, emésztőrendszeri tünetek: csökkent étvágy, hányás, hányinger
7.1.3.3.3. idegrendszeri tünetek: fejfájás, szédülés
7.1.3.4. A mellékhatások kezelése érdekében a daclatasvir dózisának módosítása nem javasolt. Súlyos mellékhatások fellépésekor a teljes kezelési séma leállítása szükséges.
7.1.3.5. A daclatasvirrel végzett monoterápia tilos.
7.1.4. Dasabuvir NS5B RNS-függő RNS-polimeráz inhibitor specifikus alkalmazási szempontok
7.1.4.1. Adagolás: 250 mg (egy tabletta) naponta kétszer (reggel és este). (ld. alkalmazási előírás)
7.1.4.2. A dasabuvirt tilos monoterápiában alkalmazni.
7.1.4.3. A dasabuvirt mindig ombitasvir/paritaprevir/ritonavir kombinációval kell együtt alkalmazni.
7.1.4.4. A leggyakoribb mellékhatások:
7.1.4.4.1. általános tünetek: fáradtság
7.1.4.4.2. emésztőrendszeri tünetek: émelygés
7.1.4.4.3. pszichiátriai tünetek: álmatlanság
7.1.4.4.4. bőr, bőr alatti szövet betegségei: viszketés
7.1.5. Ombitasvir 12,5 mg/ paritaprevir 75 mg/ ritonavir 50 mg
7.1.5.1. Adagolás: naponta egyszer 2 tabletta, étkezés közben
7.1.5.2. Dasabuvirral történő kombinációban adható
7.1.6. Ledipasvir 90 mg/ sofosbuvir 400 mg
7.1.6.1. Adagolás: naponta egy tabletta, étkezés közben vagy étkezéstől függetlenül bevéve
7.1.6.2. A leggyakoribb mellékhatások:
7.1.6.2.1. általános tünetek: fáradtság,
7.1.6.2.2. idegrendszeri tünetek: fejfájás
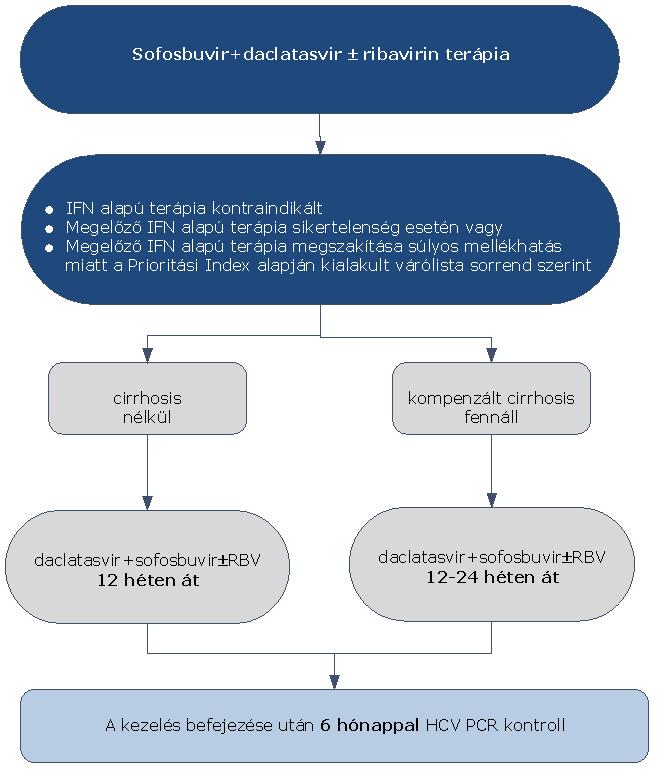
7.1.7. A HCV G1 genotípusú, sofosbuvir + daclatasvir ± ribavirin alapú kezelése:
7.1.8. Az algoritmus részletezése
A sofosbuvir+daclatasvir interferon mentes kettős terápia azon betegek csoportjában alkalmazható OEP finanszírozással, akik esetében:
7.1.8.1. az interferon alapú terápia kontraindikált vagy
7.1.8.2. megelőzően végzett interferon alapú, PI-t (proteáz-gátlót) is tartalmazó hármas kezelés súlyos mellékhatások miatt megszakításra került vagy
7.1.8.3. megelőzően végzett interferon alapú PI-t tartalmazó hármas kezelés sikertelen volt. A kezelés megkezdése az ismételten meghatározott Prioritási Index alapján kialakult várólista sorrend szerint történik.
7.1.8.4. Azon betegek esetében, akiknél nem áll fenn cirrhosis, a sofosbuvir+daclatasvir kettős kezelés időtartama 12 hét.
7.1.8.5. Amennyiben a betegeknél kompenzált cirrhosis fennáll, a terápia 12–24 hétig tart. RBV együttes adása nem szükséges.
7.1.8.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
7.1.8.7. A sofosbuvir+daclatasvir kombinációval végzett kezelés leállítására vonatkozó STOP szabály nem ismert.
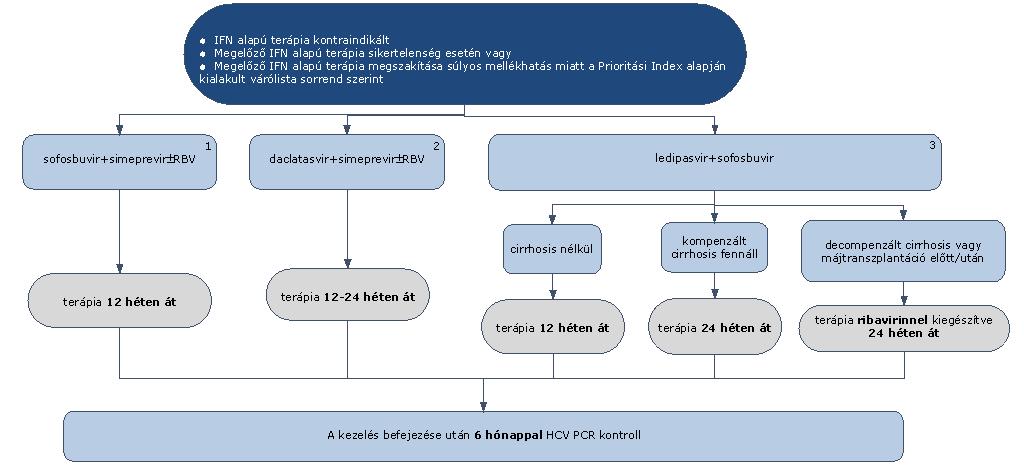
7.1.9. További IFN mentes terápiák a HCV G1 genotípusú fertőzésben szenvedő betegek részére:
7.1.9.1. Sofosbuvir+simeprevir kombinációs kezelés (1) hossza a naiv-nak minősülő és korábbi PegIFN+RBV kettős kezeléssel sikertelenül kezelt betegeknél egyaránt 12 hét. Sofosbuvir+simeprevir kombinációhoz a ribavirin hozzáadása negatív prediktorok megléte esetén vagy G1a genotípusnál lehet indokolt a 12 hetes terápia alatt.
7.1.9.2. Sofosbuvir+simeprevir kombinációs kezelés a PegIFN+RBV+PI kezelés során meg nem gyógyult betegek kezelésére PI rezisztencia miatt nem ajánlott.
7.1.9.3. Daclatasvir+simeprevir kombinációs kezelés (2) G1b genotípus esetén indokolt. Naiv-nak minősülő G1b betegek kezelésének időtartama 12 hét. RBV együttes adása nem szükséges.
7.1.9.4. PegIFN+RBV terápiára nem reagáló betegek kezelésének időtartama 24 hét. RBV együttes adása szükséges.
7.1.9.5. A daclatasvir más szerrel is adható kombinációban, monoterápiában tilos alkalmazni.
7.1.9.6. Ledipasvir+sofosbuvir (3) kombinációs kezelés időtartama cirrhosisban nem szenvedő betegek esetében 12 hét. Korábban nem kezelt, G1 genotípusú betegek esetében elegendő lehet a 8 hét. Korábban már kezelt betegeknél, akiknél bizonytalan a későbbi ismételt kezelési lehetőség, valamint cirrhosis esetén (beleértve a dekompenzált májcirrhosist) ribavirinnel együtt adandó, az alkalmazási előirat szerint.
7.1.9.7. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
7.1.9.8. Dasabuvir + ombitasvir/paritaprevir/ritonavir ± ribavirin
7.1.9.9. Dasabuvir+ombitasvir/paritaprevir/ritonavir±ribavirin kombinációs kezelés 1a és 1b genotípus esetén alkalmazható, kompenzált cirrhosis fennállása esetén vagy cirrhosis nélküli betegeknek.
7.1.9.10. 1b genotípus esetén (1), amennyiben cirrhosis nem áll fenn, dasabuvir+ombitasvir/paritaprevir/ritonavir kombinációból elhagyható a ribavirin. A kezelés időtartama 12 hét. (3)
7.1.9.11. 1b genotípus esetén, amennyiben kompenzált cirrhosis fennáll, dasabuvir+ombitasvir/paritaprevir/ritonavir+ ribavirin kombinációs kezelés adható. A kezelés időtartama 12 hét. (4)
7.1.9.12. 1a genotípus esetén (2), amennyiben cirrhosis nem áll fenn, dasabuvir+ombitasvir/paritaprevir/ritonavir+ ribavirin kombinációs kezelés adható. A kezelés időtartama 12 hét. (4)
7.1.9.13. 1a genotípus esetén, amennyiben kompenzált cirrhosis fennáll, dasabuvir+ombitasvir/paritaprevir/ritonavir+ ribavirin kombinációs kezelés adható. A kezelés időtartama 24 hét. (5)
7.1.9.14. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
8. A finanszírozási ellenőrzés alapját képező ellenőrzési sarokpontok
8.1. Az interferon terápia előtt a szükséges diagnosztikai kritériumok teljesültek-e?
8.2. A betegek beválogatása a Hepatitis Terápiás Bizottság engedélye alapján és a Prioritási Indexnek megfelelően történt-e?
8.3. Történt-e májbiopszia, transiens elastographia vagy más validált nem-invazív módszer a fibrosis stádiumának meghatározására normál GPT esetén?
8.4. A kezelés előtt minden betegnél történt-e PCR vizsgálat?
8.5. A gyógyszeres terápia hossza a beteg labor eredményei alapján alátámasztott és dokumentált-e?
8.5.1. Az algoritmus szerinti időpontokban a szükséges vírusvizsgálat megtörtént-e?
8.5.2. A kezelés hossza ennek megfelelő volt-e?
8.6. A terápia befejezését követően legalább 24 héttel PCR vizsgálat történt-e?
9. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
9.1. A területre fordított közkiadások alakulása
9.2. A finanszírozott algoritmus szerint kezelt betegek aránya
10. A finanszírozás szempontjából lényeges kódok
|
BNO |
BNO megnevezés |
|
B1820 |
Idült vírusos C-típusú hepatitis |
|
OENO |
OENO megnevezés |
|
11041 |
Vizsgálat |
|
88460 |
Vérvétel |
|
99910 |
Kiegészítő pont veszélyeztető beteg ellátásáért |
|
28014 |
Vérkép automatával IV. |
|
24600 |
Aszpartát-amino-transzferáz (ASAT, GOT) meghatározása |
|
24610 |
Alanin-amino-transzferáz (ALAT, SGPT) meghatározása |
|
24640 |
Gamma-glutamil-transzferáz meghatározása |
|
24720 |
Alkalikus foszfatáz meghatározása |
|
24741 |
Pszeudo-kolineszteráz meghatározása |
|
21020 |
Összfehérje meghatározása szérumban |
|
21040 |
Albumin meghatározása szérumban, festékkötő módszerrel |
|
21310 |
Glükóz meghatározása |
|
21420 |
Összkoleszterin meghatározása |
|
21411 |
Trigliceridek meghatározása |
|
21150 |
Összes bilirubin meghatározása szérumban |
|
21151 |
Konjugált bilirubin meghatározása szérumban |
|
28620 |
Prothrombin meghatározása |
|
21120 |
Karbamid meghatározása szérumban |
|
21140 |
Kreatin meghatározása |
|
2627T |
Hepatitis C vírus AT kimutatása |
|
2639A |
HBsAg AG kimutatása |
|
26261 |
HIV AT kimutatása |
|
24060 |
TSH meghatározása (Thyreoidea-Stimuláló Hormon) |
|
25567 |
Hepatitis C vírus kvantitatív meghatározása, molekuláris biológiai módszerrel |
|
25566 |
Hepatitis C vírus kvalitatív meghatározása, molekuláris biológiai módszerrel |
|
25569 |
HCV genotípus meghatározása molekuláris diagnosztikai módszerrel |
|
25572 |
Hepatitis B vírus gyógyszer-rezisztens mutánsainak meghatározása PCR alapú módszerrel |
|
29000 |
Szövettani vizsgálat a szokásos feldolgozási módszerrel |
|
36130 |
Hasi (áttekintő, komplex) UH vizsgálat |
|
3613D |
Tranziens elasztográfia |
|
81581 |
UH vezérelt májbiopsia |
|
81580 |
Aspiratio hepatis |
|
92231 |
Immunmoduláció |
|
91311 |
Krónikus beteg dietetikai alapoktatása (gastroenterológiai, nephrológiai, onkológiai vagy 2. típusú diabeteses betegnél) |
|
HBCS |
HBCS megnevezés |
|
351B |
Májbetegségek, kivéve rosszindulatú daganatok, cirrhosis |
|
9422 |
Kiegészítő HBCs transzplantátummal élő személy ellátására |
|
3480 |
Májcirrhosis |
|
ATC |
ATC megnevezés |
|
L03AB04 |
interferon alfa-2a |
|
L03AB01 |
interferon alfa természetes |
|
L03AB05 |
interferon alfa-2b |
|
L03AB11 |
peg-Interferon alfa-2a |
|
L03AB10 |
peg-Interferon alfa-2b |
|
J05AB04 |
ribavirin |
|
J05AE11 |
telaprevir |
|
J05AE12 |
boceprevir |
|
J05AE14 |
simeprevir |
|
J05AX14 |
daclatasvir |
|
J05AX15 |
sofosbuvir |
|
J05AX16 |
dasabuvir |
|
J05AX67 |
ombitasvir, paritaprevir, ritonavir |
|
J05AX65 |
ledipasvir, sofosbuvir |
|
11.1. |
ALT |
Alanin aminotranszferáz |
|
11.2. |
ATC |
Anatomical Therapeutic Chemical klasszifikáció |
|
11.3. |
BNO |
Betegségek nemzetközi osztályozása |
|
11.4. |
CHC |
Krónikus hepatitis C |
|
11.5. |
GPT |
Glutamát-piruvát transzamináz |
|
11.6. |
HBCS |
Homogén betegségcsoport |
|
11.7. |
HCC |
HepatoCelluláris Carcinoma |
|
11.8. |
HCV |
Hepatitis C vírus |
|
11.9. |
OENO |
Orvosi eljárások nemzetközi osztályozása |
|
11.10. |
PCR |
Polymerase Chain Reaction |
|
11.11. |
PegIFN |
Pegilált interferon |
|
11.12. |
PI |
Proteáz inhibitor |
|
11.13. |
PR |
Pegilált interferon ribavirin |
|
11.14. |
RVR |
Rapid vírusválasz |
|
11.15. |
eRVR |
Extended rapid viral response (kiterjesztett rapid vírus válasz) |
|
11.16. |
RBV |
Ribavirin |
|
11.17. |
StdIFN |
Hagyományos interferon |
|
11.18. |
SVR |
Sustained virologic response (tartós virológiai válasz) |