15/2016. (VII. 15.) EMMI rendelet
15/2016. (VII. 15.) EMMI rendelet
a törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet és a finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosításáról1
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 48. § 2. pontjában meghatározott feladatkörömben eljárva – a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 90. § 2. pontjában meghatározott feladatkörében eljáró nemzetgazdasági miniszterrel egyetértésben –,
a 2. alcím és a 6–18. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 48. § 2. pontjában meghatározott feladatkörömben eljárva
a következőket rendelem el:
1. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosítása
1. § A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet (a továbbiakban: 32/2004. ESZCSM rendelet) a következő 26. §-sal egészül ki:
2. § (1) A 32/2004. ESZCSM rendelet 1. számú melléklete az 1. melléklet szerint módosul.
(2) A 32/2004. ESZCSM rendelet 2. számú melléklete a 2. melléklet szerint módosul.
(3) A 32/2004. ESZCSM rendelet 3. számú melléklete a 3. melléklet szerint módosul.
(4) A 32/2004. ESZCSM rendelet 4. számú melléklete a 4. melléklet szerint módosul.
(5) A 32/2004. ESZCSM rendelet 7/b. számú melléklete az 5. melléklet szerint módosul.
3. § Hatályát veszti a 32/2004. ESZCSM rendelet
a) 8. § (4) bekezdésében a „(+/–20%)”,
b) 6/a., 6/b. és 7/b. számú mellékletében a „Beadás dátuma: (OEP tölti ki)” és
c) 7/a. számú mellékletében a „Beadás dátuma: (Országos Egészségbiztosítási Pénztár tölti ki)”
szövegrész.
2. A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosítása
4. § (1) A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet (a továbbiakban: 31/2010. EüM rendelet) 6. melléklete a 6. melléklet szerint módosul.
(2) A 31/2010. EüM rendelet 15. melléklete a 7. melléklet szerint módosul.
(3) A 31/2010. EüM rendelet 16. melléklete a 8. melléklet szerint módosul.
(4) A 31/2010. EüM rendelet 20. melléklete a 9. melléklet szerint módosul.
(5) A 31/2010. EüM rendelet 21. melléklete a 10. melléklet szerint módosul.
(6) A 31/2010. EüM rendelet 23. melléklete a 11. melléklet szerint módosul.
(7) A 31/2010. EüM rendelet 24. melléklete a 12. melléklet szerint módosul.
(8) A 31/2010. EüM rendelet 28. melléklete a 13. melléklet szerint módosul.
(9) A 31/2010. EüM rendelet 30. melléklete a 14. melléklet szerint módosul.
(10) A 31/2010. EüM rendelet 32. melléklete a 15. melléklet szerint módosul.
(11) A 31/2010. EüM rendelet 33. melléklete a 16. melléklet szerint módosul.
(12) A 31/2010. EüM rendelet 36. melléklete a 17. melléklet szerint módosul.
(13) A 31/2010. EüM rendelet 41. melléklete a 18. melléklet szerint módosul.
5. § Hatályát veszti a 31/2010. EüM rendelet 5. § (16) bekezdése és 34. melléklete.
3. Záró rendelkezések
6. § Ez a rendelet 2016. augusztus 1-jén lép hatályba.
1. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT INDI- KÁCIÓ- HOZ KÖTÖTT |
KIEMELT INDI- KÁCIÓ- |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01CA |
széles spektrumú penicillinek |
X |
X |
X |
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01CE |
béta-laktamáz érzékeny penicillinek |
X |
X |
|
|
X |
|
|
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01CR |
penicillinek kombinációi, beleértve a béta-laktamáz gátlókat |
X |
X |
X |
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01DC |
második generációs cephalosporinok |
X |
X |
X |
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01DD |
harmadik generációs cephalosporinok |
X |
X |
|
|
X |
|
|
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01EE |
Szulfonamidok és trimethropim kombinációi |
X |
X |
|
|
X |
|
|
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
J01FA |
makrolidok |
X |
X |
|
|
X |
X |
|
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
||||||
|
NORMATÍV |
EMELT |
KIEMELT |
KÜLÖN- KERET) |
|||||
|
0% |
25% |
55% |
80% |
|||||
|
ÉRTÉK NÉLKÜL |
ÁTLA- GON ALULI |
ÁTLA- GOS |
ÁTLA- GON FELÜLI |
|||||
|
L04AC |
Interleukin-gátlók |
X |
X |
2. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Kijelölt intézmény |
Neurológia |
írhat |
|
Város |
Intézmény neve |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Péterfy Sándor Utcai Kórház-Rendelőintézet és Baleseti Központ |
|
Budapest |
Semmelweis Egyetem Neurológiai Klinika |
|
Budapest |
Bajcsy-Zsilinszky Kórház és Rendelőintézet |
|
Budapest |
Szent Imre Kórház |
|
Budapest |
Szent János Kórház és Észak-budai Egyesített Kórházak |
|
Budapest |
Semmelweis Egyetem Kútvölgyi Neurológiai Klinikai Csoport |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Budapest |
Uzsoki Utcai Kórház |
|
Budapest |
Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet |
|
Budapest |
Országos Klinikai és Idegtudományi Intézet |
|
Budapest |
Országos Reumatológiai és Fizioterápiás Intézet |
|
Debrecen |
Debreceni Egyetem Klinikai Köpont, Neurológiai Klinika Neuroimmunológia |
|
Debrecen |
Kenézy Gyula Kórház és Rendelőintézet |
|
Eger |
Markhot Ferenc Kórház Kft. |
|
Esztergom |
Vaszary Kolos Kórház |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Kistarcsa |
Pest Megyei Flór Ferenc Kórház |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Neurológiai Klinika |
|
Salgótarján |
Szent Lázár Megyei Kórház |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Neurológiai Klinika |
|
Székesfehérvár |
Fejér Megyei Szent György Egyetemi Oktató Kórház |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szolnok |
Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Zalaegerszeg |
Zala Megyei Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Heim Pál Gyermekkórház |
|
Budapest |
Szent János Kórház és Észak-budai Egyesített Kórházak |
|
Budapest |
Semmelweis Egyetem I. és II. sz. Gyermekgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem I. és II. sz. Belgyógyászati Klinika – Endokrinológia |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Debrecen |
Debreceni Egyetem Klinikai Központ Gyermekklinika, I. sz. Belgyógyászati Klinika Endokrinológiai Tanszék |
|
Eger |
Markhot Ferenc Kórház Kft. |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Hódmezővásárhely |
Erzsébet Kórház-Rendelőintézet |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ Gyermekgyógyászati Klinika |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ I. sz. Belgyógyászati Klinika Endokrinológia |
|
Salgótarján |
Szent Lázár Megyei Kórház |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ Endokrinológia |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ Gyermekgyógyászati Klinika |
|
Szolnok |
Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Magyar Honvédség Egészségügyi Központ, I. Belgyógyászati Osztály |
|
Budapest |
Semmelweis Egyetem I., II., III. sz. Belgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ II. sz. Belgyógyászati Klinika |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Miskolci Semmelweis Kórház és Egyetemi Oktatókórház |
|
Mosonmagyaróvár |
Karolina Kórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ I. sz. Belgyógyászati Klinika |
|
Sopron |
Országos Vérellátó Szolgálat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ II. sz. Belgyógyászati Klinika |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Tatabánya |
Szent Borbála Kórház, Belgyógyászat Onko-Hematológia részlege |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Bajcsy-Zsilinszky Kórház és Rendelőintézet |
|
Budapest |
Országos Onkológiai Intézet |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika, Urológiai Klinika |
|
Budapest |
Szent Margit Kórház |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Budapest |
Uzsoki Utcai Kórház |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Onkológiai Tanszék |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Onkoterápiás Klinika |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Onkoterápiás Klinika |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Zalaegerszeg |
Zala Megyei Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Bajcsy-Zsilinszky Kórház és Rendelőintézet |
|
Budapest |
Országos Onkológiai Intézet |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika, Urológiai Klinika |
|
Budapest |
Szent Margit Kórház |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Budapest |
Uzsoki Utcai Kórház |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Onkológiai Tanszék |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Onkoterápiás Klinika |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Onkoterápiás Klinika |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Zalaegerszeg |
Zala Megyei Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Magyar Honvédség Egészségügyi Központ, I. Belgyógyászati Osztály |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem II. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem III. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem I. sz. Gyermekgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem II. sz. Gyermekgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, II. Belgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Gyermekklinika |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Miskolci Semmelweis Kórház és Egyetemi Oktatókórház |
|
Mosonmagyaróvár |
Karolina Kórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Gyermekgyógyászati Klinika |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ I. sz. Belgyógyászati Klinika |
|
Sopron |
Országos Vérellátó Szolgálat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Belgyógyászati Klinika Haematológiai Osztály |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Gyermekgyógyászati Klinika |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház, Haematológiai és Haemostaseológiai Osztály |
|
Tatabánya |
Szent Borbála Kórház, Belgyógyászat Onko-Hematológia részlege |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Magyar Honvédség Egészségügyi Központ, I. Belgyógyászati Osztály |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet Haematológiai és Csontvelőtranszplantációs Osztály, I. Belgyógyászat |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem II. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem III. sz. Belgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ Belgyógyászati Intézet |
|
Győr |
Petz Aladár Megyei Oktató Kórház II. sz. Belgyógyászat-Haematológiai Osztály |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Miskolci Semmelweis Kórház és Egyetemi Oktatókórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ I. sz. Belgyógyászati Klinika |
|
Sopron |
Országos Vérellátó Szolgálat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ II. sz. Belgyógyászati Klinika |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Tatabánya |
Szent Borbála Kórház, Belgyógyászat Onko-Haematológiai részlege |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Járóbeteg szakrendelés / |
Gastroenterológia |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Klinikai onkológia |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Sebészet |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Sugártherápia |
javasolhat és írhat |
|
Háziorvos |
Megkötés nélkül |
javaslatra írhat |
|
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap |
||
3. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Járóbeteg szakrendelés / |
Csecsemő- és gyermekgyógyászat |
írhat |
|
Háziorvos |
Megkötés nélkül |
írhat |
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Járóbeteg szakrendelés / |
Allergológia és klinikai immunológia |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Csecsemő-gyermekgyógyászat |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Gyermektüdőgyógyászat |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Tüdőgyógyászat |
javasolhat és írhat |
|
Háziorvos |
Megkötés nélkül |
javaslatra írhat |
|
Megkötés nélkül |
Allergológia és klinikai immunológia |
írhat |
|
Megkötés nélkül |
Csecsemő-gyermekgyógyászat |
írhat |
|
Megkötés nélkül |
Gyermektüdőgyógyászat |
írhat |
|
Megkötés nélkül |
Tüdőgyógyászat |
írhat |
|
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap |
||
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Járóbeteg szakrendelés / |
Gyermektüdőgyógyászat |
javasolhat és írhat |
|
Járóbeteg szakrendelés / |
Tüdőgyógyászat |
javasolhat és írhat |
|
Háziorvos |
Megkötés nélkül |
javaslatra írhat |
|
Megkötés nélkül |
Gyermektüdőgyógyászat |
írhat |
|
Megkötés nélkül |
Tüdőgyógyászat |
írhat |
|
|
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap |
|
4. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
5. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
|
– már támogatott tápszer kiadhatóságának változása |
□ |
|
– már támogatott tápszer névváltozása |
□ |
|
– már támogatott tápszer törlése |
□ |
|
– már támogatott tápszer árcsökkentése |
□ |
|
– nyilvántartási szám változása |
□ |
|
– támogatás megszüntetése [Gyftv. 29. § (4) bekezdés b) pontja] |
□ |
6. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
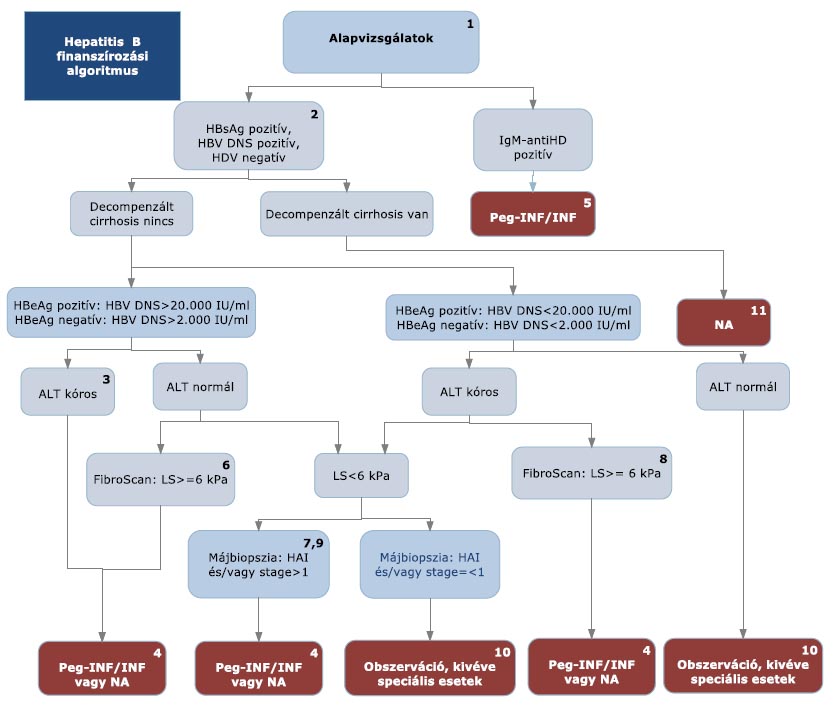 ”
”7. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
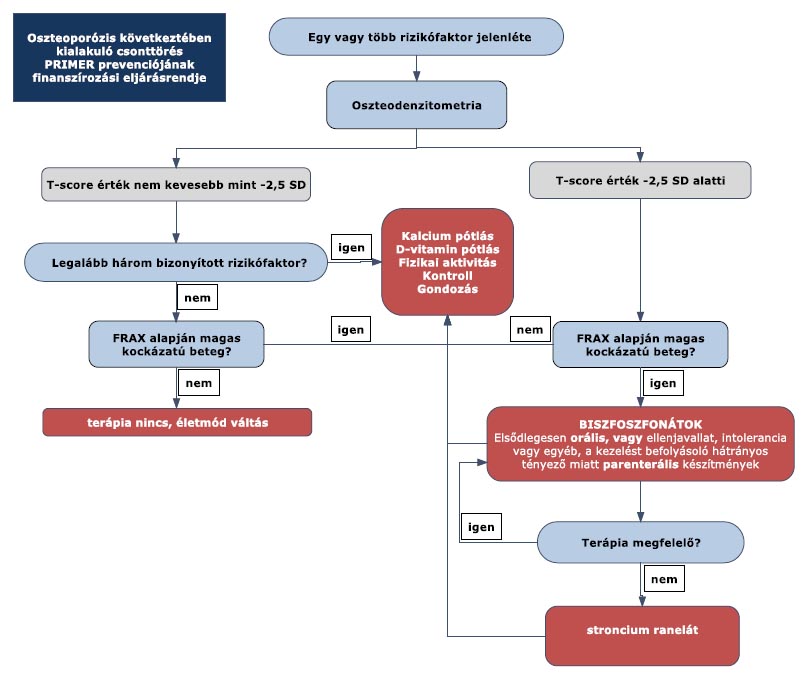
8. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
9. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
10. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
11. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
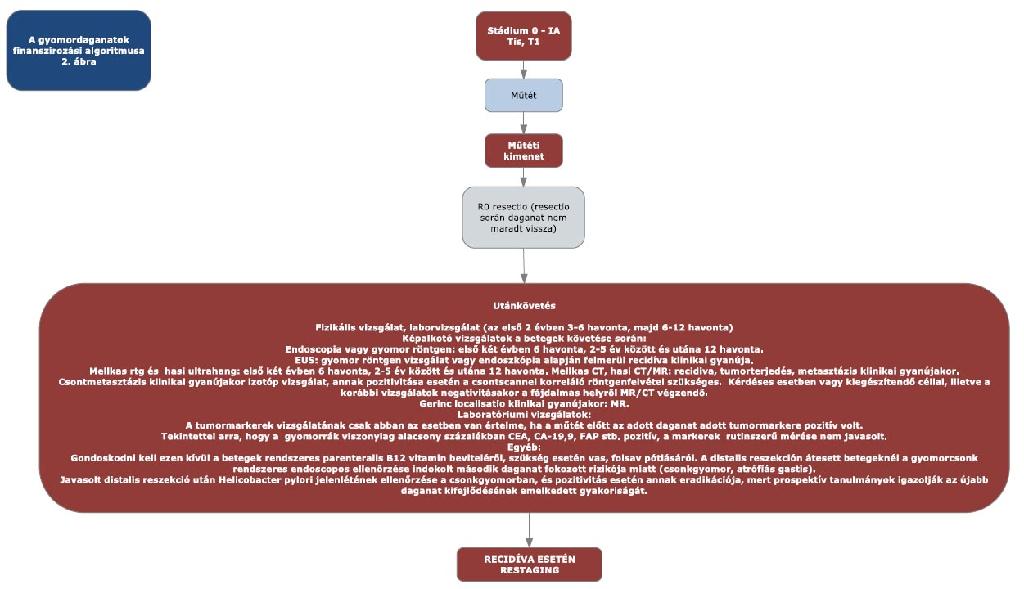
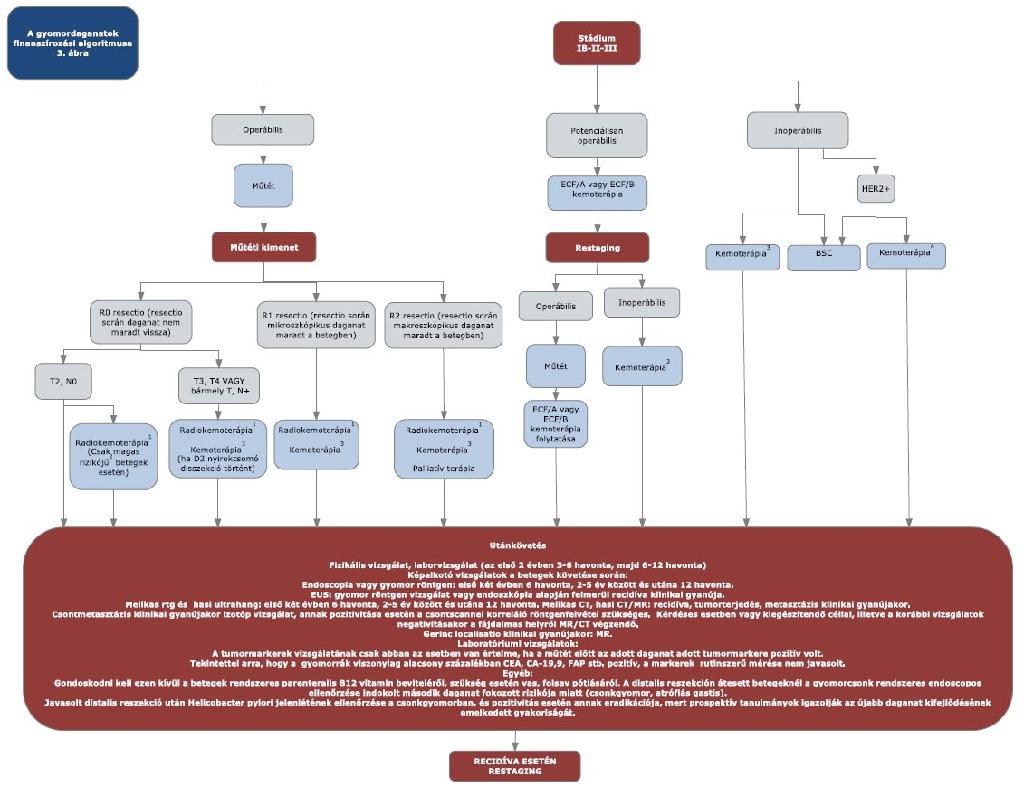
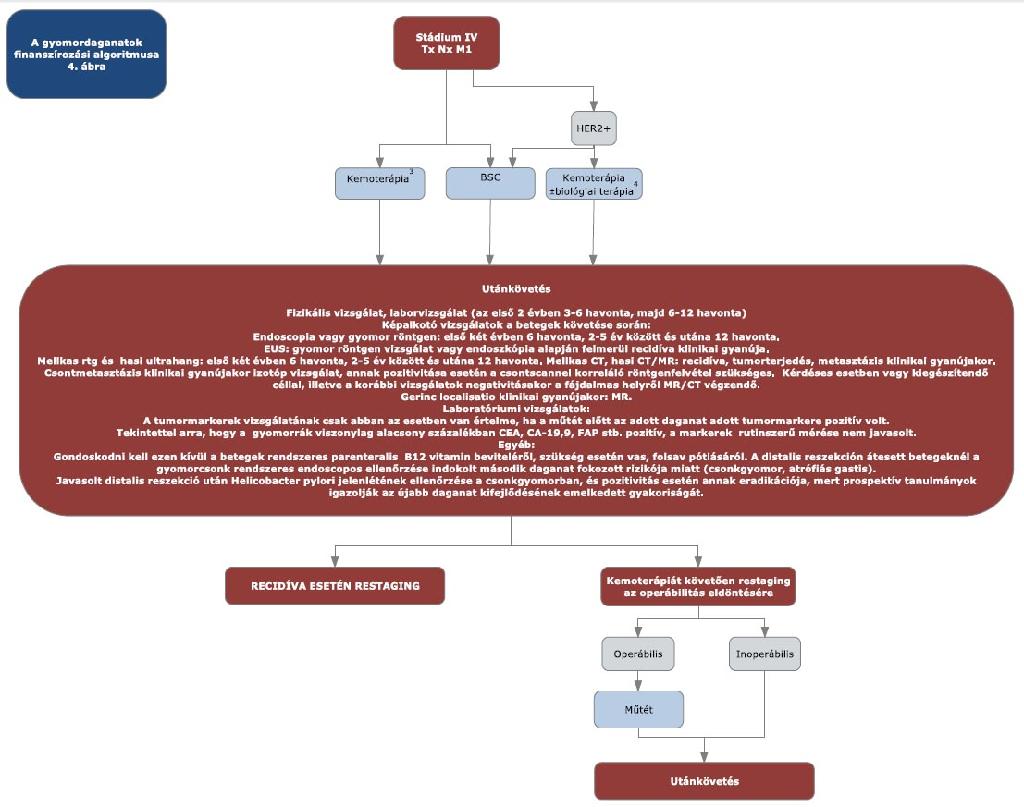
12. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
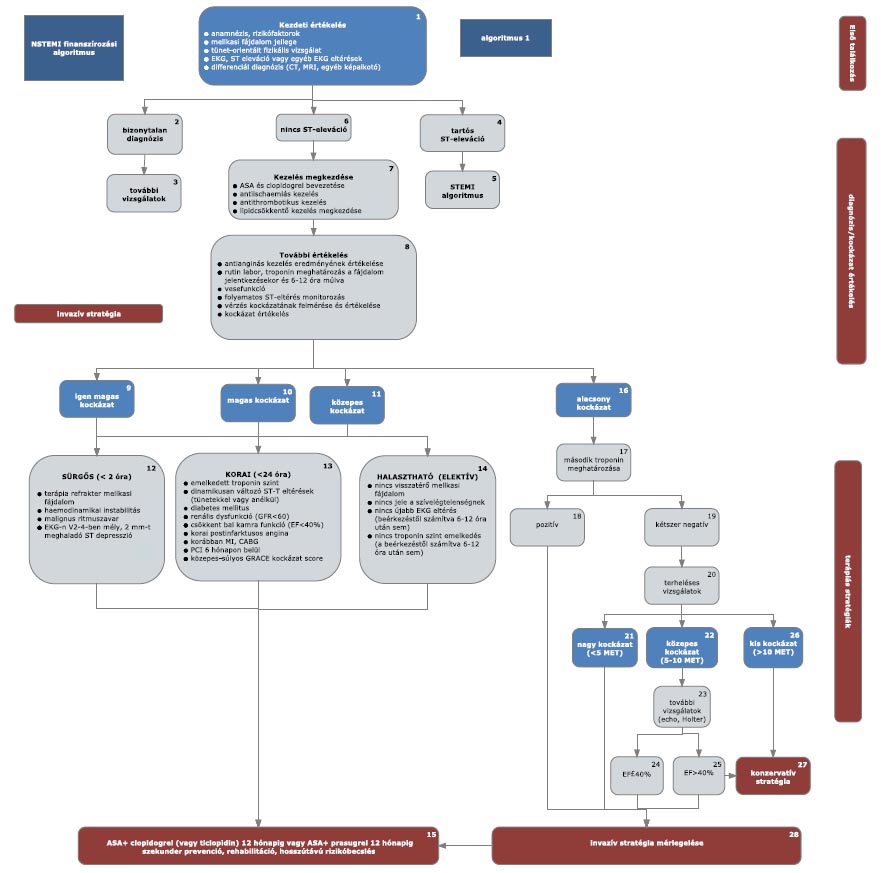
13. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
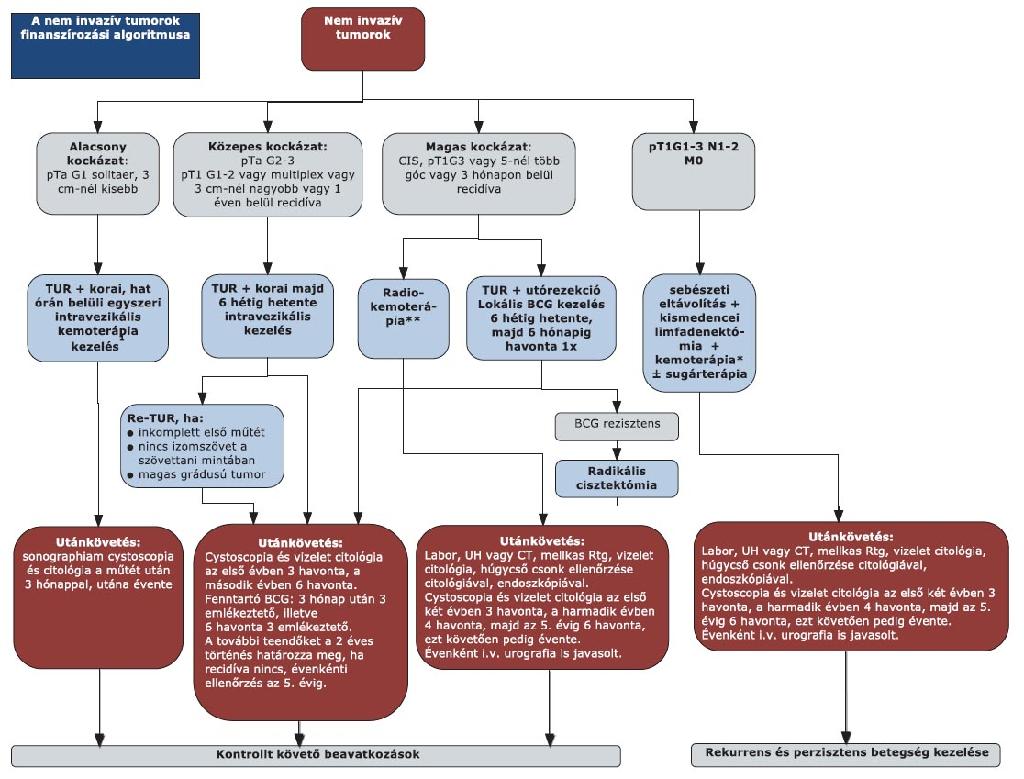
14. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
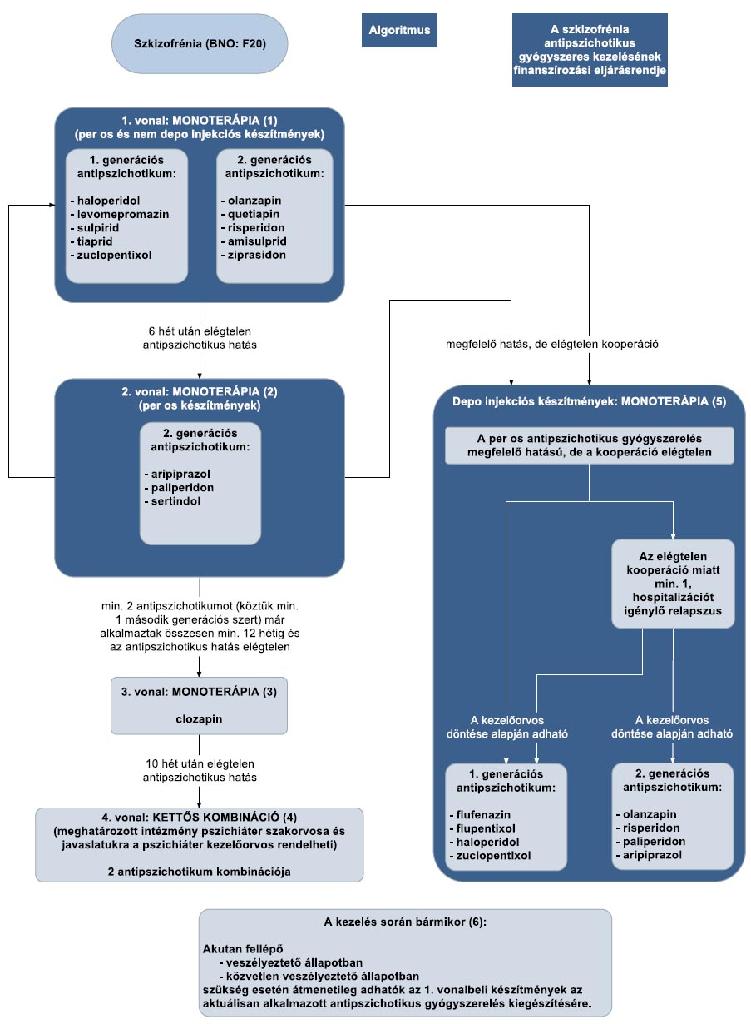
15. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
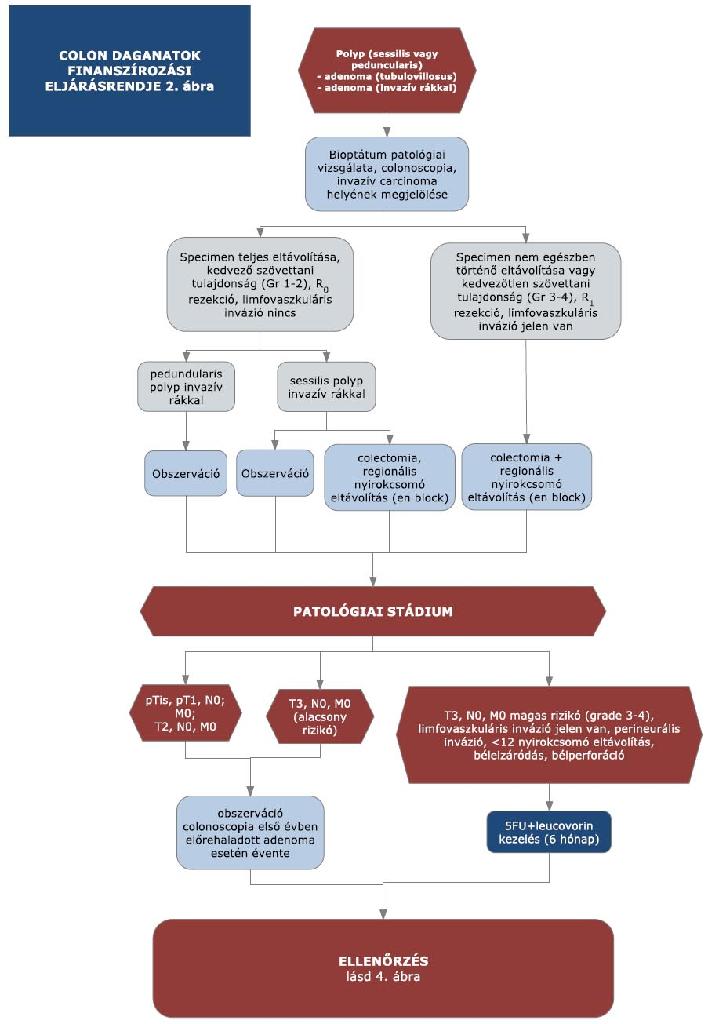
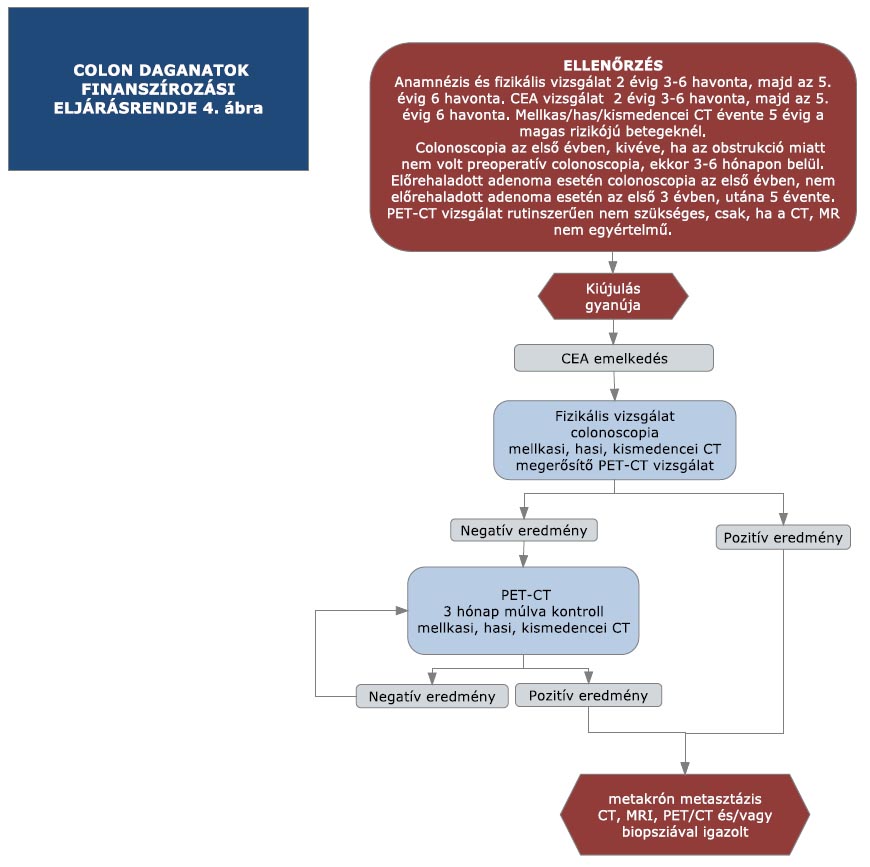
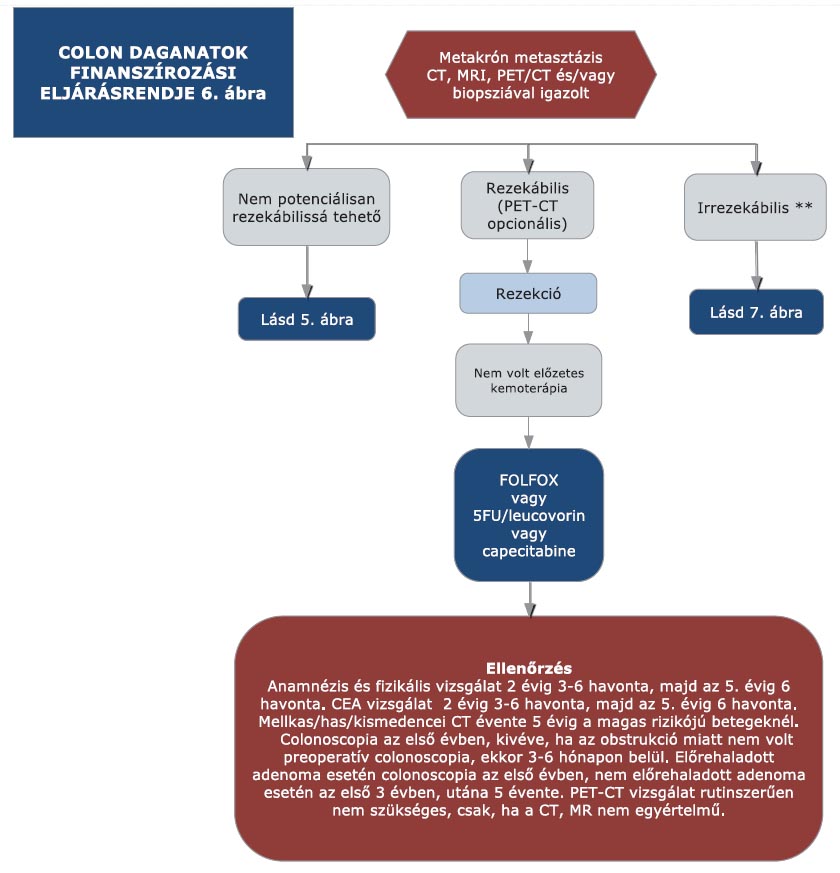
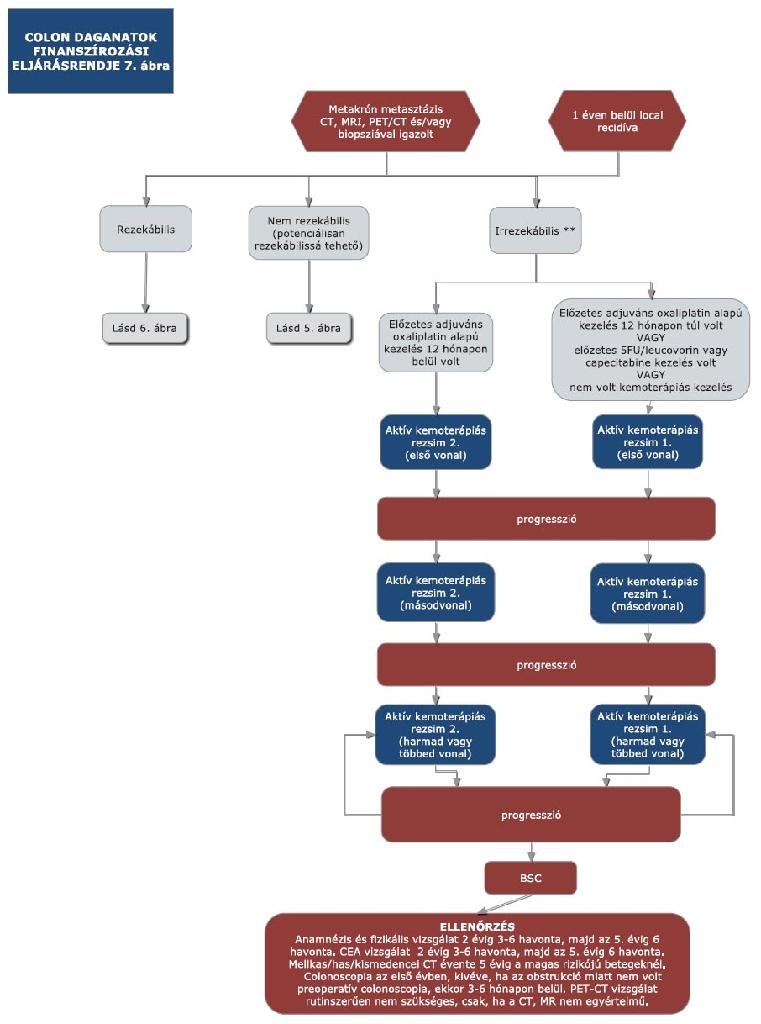
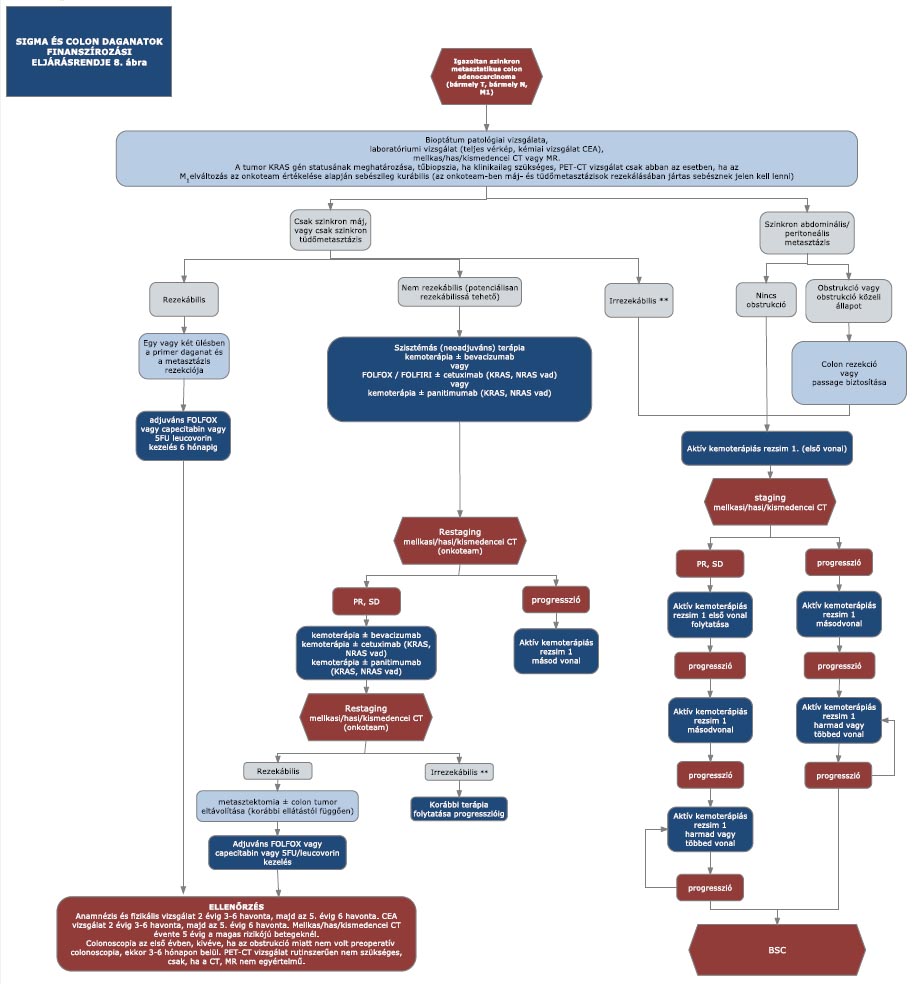

16. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
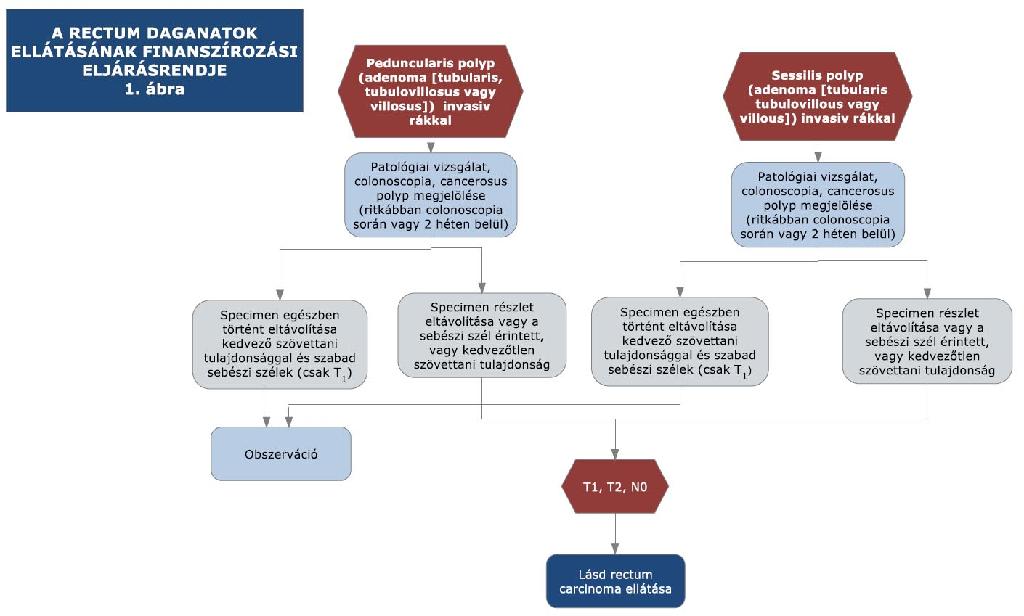
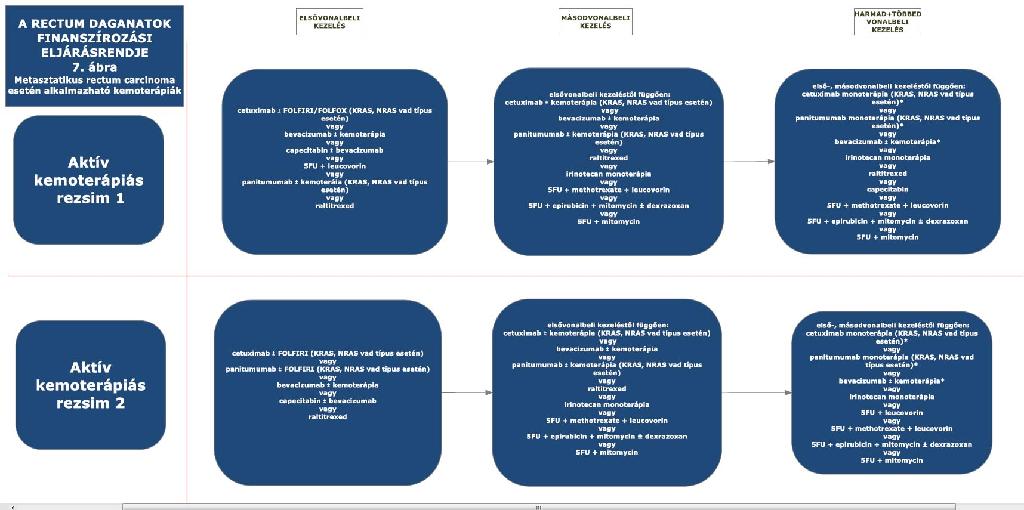
17. melléklet a 15/2016. (VII. 15.) EMMI rendelethez

18. melléklet a 15/2016. (VII. 15.) EMMI rendelethez
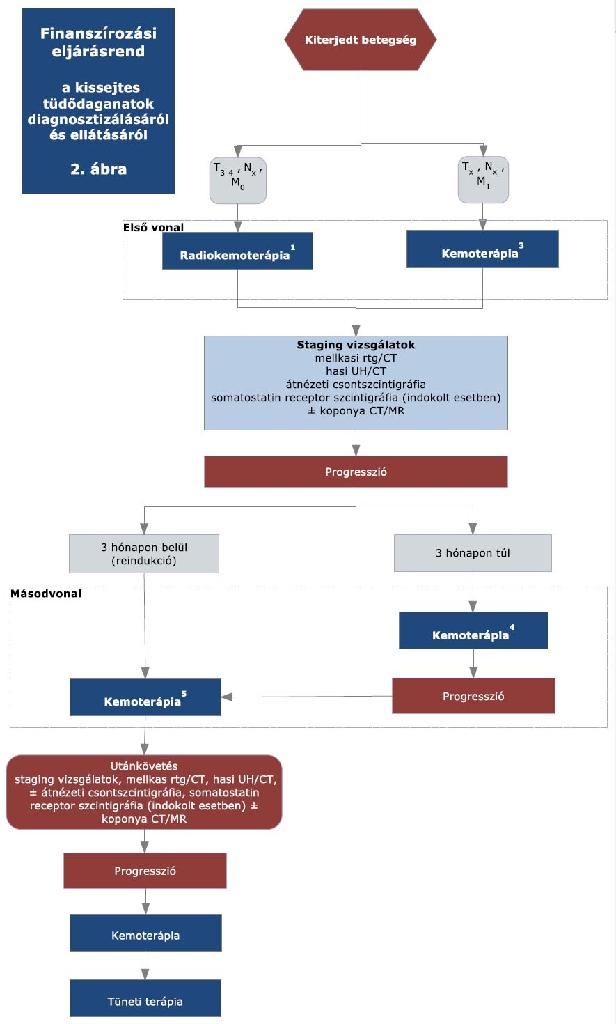
A rendelet a 2010: CXXX. törvény 12. § (3) bekezdése alapján hatályát vesztette 2016. augusztus 2. napjával.
- Hatályos
- Már nem hatályos
- Még nem hatályos
- Módosulni fog
- Időállapotok
- Adott napon hatályos
- Közlönyállapot
- Indokolás



